网址:http://m.1010jiajiao.com/timu3_id_81282[举报]
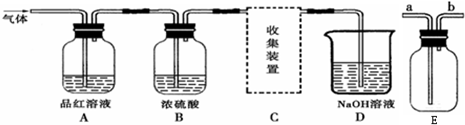
【实验探究】
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为
(2)A装置观察到的现象是
(3)B装置中浓硫酸的作用是
(4)D装置的作用是
【实验讨论】
对上图中的C处,甲乙两同学都选用图E装置,但对连接方式持有不同意见.
甲同学认为:SO2气体应从a处通入集气瓶中.
乙同学认为:SO2气体应从b处通入集气瓶中.
你认为
(已知:同等条件下二氧化硫的密度大于空气)
【联系实际】
SO2对环境的影响较大,为了减少SO2对空气的污染,请你提出一种有效的措施.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择:
(2)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是
 Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑ Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑(3)放出的气体是
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 正极 | NaOH | Al-3e-=Al3+ | 2H2O+2e-=2OH-+H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Cu-2e--=Cu2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
| D | 负极 | 稀硝酸 | Cu-2e-=Cu2+ | 2NO3-+8H+=2NO↑+4H2O+6e- |
某研究性学习小组设计实验方案制备氯化铜并验证次氯酸的漂白性。
已知氯化铜遇水蒸气潮解。

根据上述仪器组合装置,回答下列问题:
(1)组装实验装置:气体流向从左至右,导管口的连接顺序为__________________。
(2)为了防止空气与铜粉反应,先点燃________处酒精灯,当___________________时,再点燃另一酒精灯。
(3)D装置的作用是________________________,
F装置的作用是___________________________。
(4)能证明氯气没有漂白性,次氯酸有漂白性的实验现象________________________________________________________________________。
(5)本实验方案没有除去氯气中的氯化氢,对实验有无影响?________;理由是
________________________________________________________________________。
查看习题详情和答案>>
某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO。
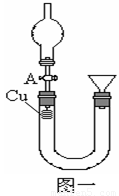
(1)补充完成下列实验步骤:
①__________________________________________;
②打开活塞A,往U型管右侧漏斗中注入稀硝酸,一直注到稀HNO3接触到A处橡皮塞为止;
③关闭活塞A,观察实验现象。
(2)记录描述观察到的实验现象:
可观察到的现象有:U型管左侧铜丝逐渐溶解,有_____色气体产生,溶液呈______色,随着反应不断进行,最后反应自行停止,该过程反应的离子方程式为________________________________。
(3)试管内装有NO,倒置于水槽中,当向试管内通入21mLO2时,最后试管中的液面仍在原来的位置,则原试管中NO的体积为_________mL。
(4)0.1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量_______g。若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入2 mol·L-1的氢氧化钠溶液 _mL。
查看习题详情和答案>>
(15分)某研究性学习小组设计实验探究铝等金属的性质:将铝片(不除氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡。触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
⑴铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是 。
A.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
B.硫酸铜水解生成硫酸使铝钝化
C.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
D.生成氯化铝溶于水,而生成硫酸铝不溶于水
请设计一个简单实验验证你的选择: 。
⑵铝片表面出现的暗红色物质的过程中发生的离子反应方程式是 。用离子方程式解释产生气泡的原因: 。
⑶放出的气体是 ,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是 。(写出一点即可)
⑷某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是 。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
⑸除去氧化铝的铝片与铜片为电极,在X电解质溶液中构成原电池,列表如下:
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 正极 | NaOH | Al-3e-=Al3+ | 2H2O+2e-=2OH-+H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Cu-2e--=Cu2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
| D | 负极 | 稀硝酸 | Cu-2e-=Cu2+ | 2NO3-+8H+=2NO↑+4H2O+6e- |