网址:http://m.1010jiajiao.com/timu3_id_81277[举报]
碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
|
开始沉淀pH |
4.2 |
5.8 |
1.2 |
|
完全沉淀pH |
6.7 |
8.3 |
3.2 |
(1)氯酸钠的作用是 ;滤渣的主要成分是 (写化学式)。
(2)调节反应A后溶液的pH范围应为 。可以选择的试剂是 (填序号)。
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是 。(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净? 。
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。
① 若沉淀只有CuCO3,则相应的离子方程式为 。
② 若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程 。
③ 若生成Cu(OH)2和CuCO3的混合物(即碱式盐)。则说明 。
(6)碱式碳酸铜组成可表示为:aCuCO3•bCu(OH)2•cH2O,现通过下列方案测定其组成。步骤如下:
① 称量样品;② 高温分解;③ 测出CO2的质量;④ 测出水蒸汽的质量;⑤ 称量CuO。
请对上述测定方案作出评价。 。
查看习题详情和答案>>
碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
|
物 质 |
Cu(OH)2 |
Fe (OH)2 |
Fe (OH)3 |
|
开始沉淀pH |
4.2 |
5.8 |
1.2 |
|
完全沉淀pH |
6.7 |
8.3 |
3.2 |
(1)滤渣的主要成分是 (写化学式)。
(2)调节反应A后溶液的pH范围应为 。选择的试剂最合适的是 (填序号)。
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是 。
(4)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。用相应的离子方程式表示:
① 沉淀只有CuCO3: ;
② 沉淀只有Cu(OH)2 且放出气泡: 。
(5)碱式碳酸铜的组成可表示为:aCuCO3•bCu(OH)2•cH2O。要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称量样品的质量;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO的质量。而乙同学认为除步骤②外,实验只需测定四个量中的三个即可,则合理的组合为 (填序号,写一组即可)。
查看习题详情和答案>>

(1)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去).

①仪器A的名称是
②装置B中发生反应的离子方程式是
| ||
| ||
③如果浓盐酸不能顺利滴下,可能的原因是
④装置Ⅳ中盛装的试剂是
(2)在CuCl2溶液转化为CuCl2?2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)?CuCl42-(aq)+4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K=
| c(CuCl 42- ) |
| c[Cu(H2O) 42+ ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42+ ]?c4(Cl-) |
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a.
(3)由CuCl2溶液得到CuCl2?2H2O的过程中要加入盐酸的目的是
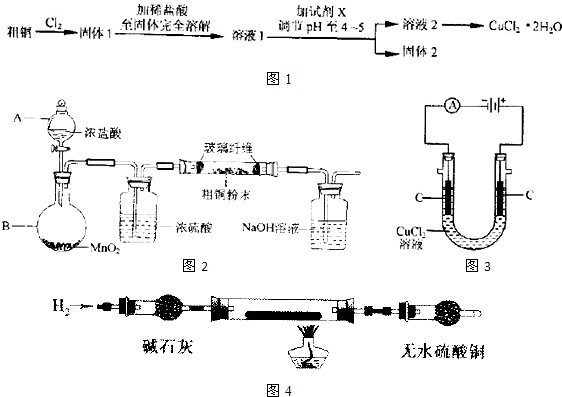
(1)实验室采用如图2所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
①装置B中发生反应的离子方程式是
| ||
| ||
②有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装胃,你认为是否必要
(2)试剂X用以除去杂质,X可选用下列试剂中的
a. NaOH b.NH3?H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色出蓝色变为绿色.小组同学欲探究其原因.
己知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)(蓝色)+4Cl-(aq)?CuCl42-(aq)(黄色)+4H2O(l)
①上述反应的化学平衡常数表达式是K=
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能证明CuCl2溶液中有上述转化关系的是(填序号)
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入NaCl固体,溶液变为绿色
c.取Y进行电解,溶液颜色最终消失
(4)如图3所示,用石墨电极电解CuCl2溶液,小组同学发现阴极碳棒上有红色和白色两种颜色的固体析出.有关文献资料表明,在铜和铜的化合物中Cu为紫红色,Cu2O为红色,CuCl为白色,它们都不溶于水.
①小组同学将阴极碳棒洗涤干净并干燥后,放入玻璃管中,按如图4所示连接装置.排净装置中的空气后,充分加热,并将一张湿润的蓝色石蕊试纸置于装置末端的导管口附近.实验中发现,碳棒上的白色物质消失,红色物质依然存在;无色硫酸铜不变色,蓝色石蕊试纸变为红色.根据上述现象,玻璃管中发生反应的化学方程式为
| ||
| ||
②电解CuCl2溶液时,阴极发生反应的电极方程式为
(CuCl2?2H2O).

(1)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
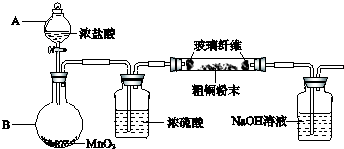
①仪器A的名称是
②装置B中发生反应的离子方程式是
| ||
| ||
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)
(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3?H2O c.CuO d.Cu2(OH)2CO3 e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:Cu(H2O)42+(aq)+4Cl-(aq)
 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)蓝色 黄色
①上述反应的化学平衡常数表达式是K=
c(Cu
| ||
c[Cu
|
c(Cu
| ||
c[Cu
|
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失.