网址:http://m.1010jiajiao.com/timu3_id_81250[举报]
(1)通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的分离方法.下图是某些金属氢氧化物在不同浓度和pH下的沉淀-溶解图.图中直线上的点表示一种平衡状态.通常认为残留在溶液中的离子浓度小于1×10-5mol?L-1时,该离子沉淀完全.
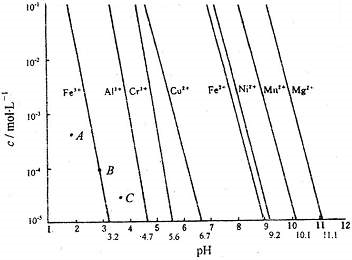
(1)则由上图可得Fe(OH)2的溶度积的值为
(2)上图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是
(3)某工厂废水(pH=2.0,ρ=1.0g?mL-1)中含Ag+、Pb2+等 重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgCl | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 1.8×10-10 | 8.3×10-17 | 5.6×10-18 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
③如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol?L-1,则该工厂处理后的废水是否符合排放标准
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2反应生成CH3OH.
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)500℃时,
在体积为1 L的容积固定的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=________mol·L-1·min-1.
②该反应的平衡常数K=________(保留一位小数),平衡时H2的转化率为________.
③已知温度升高,K值减小.下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
(2)CH3OH作为内燃机燃料或通过燃料电池驱动车辆.可减少CO2排放多达45%.
①已知:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
则反应
CH3OH(g)+②
甲醇质子交换膜燃料电池的结构示意图如下,已知H+移向通入O2的电极,甲醇进入________极(填“正”或“负”),正极发生的电极反应为________.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-49.0 kJ/mol
CH3OH(g)+H2O(g)ΔH=-49.0 kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示.
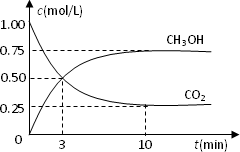
①从反应开始到平衡,氢气的平均反应速率v(H2)=________mol/(L·min).
②该反应的平衡常数表达式为________.
③下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.
已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O
则阴极反应式为:________.
有人提出,可以设计反应2CO=2C+O2(ΔH>0、ΔS<0)来消除CO的污染.请你判断是否可行并说出理由:________.
|
设NA为阿伏加德罗常数,下列说法错误的是 | |
| [ ] | |
A. |
常温常压下,16 g由O2和O3组成的混合气体所含电子数为8NA |
B. |
2g2H216O 含有的共用电子对数目为0.2NA |
C. |
常温常压下,11.2 L H2中含有的电子数为NA |
D. |
3 mol NO2与足量H2O反应,转移的电子数为2NA |