网址:http://m.1010jiajiao.com/timu3_id_81212[举报]
联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
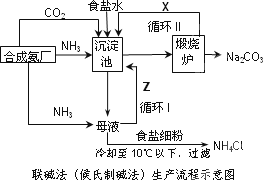
(1)沉淀池中发生反应的化学方程式为________;
(2)X是________,Y是________(填化学式);
(3)从理论上分析,在氨碱法生产过程中________(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为________;
(4)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是________;
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,
促进碳酸氢钠结晶析出
(5)相比于氨碱法,指出联碱法的一项优点________.
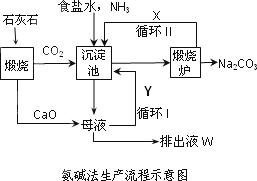
联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
(1)沉淀池中发生反应的化学方程式为________;
(2)X是________,Y是________(填化学式);
(3)从理论上分析,在氨碱法生产过程中________(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为________;
(4)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是________;
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(5)相比于氨碱法,指出联碱法的一项优点________.
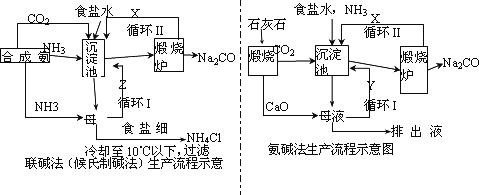
联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:


(1)沉淀池中发生反应的化学方程式为________;
(2)X是________,Y是________(填化学式);
(3)从理论上分析,在氨碱法生产过程中________(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为________;
(4)根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是________;
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(5)相比于氨碱法,指出联碱法的一项优点________.
侯德榜制碱法,也叫联合制碱法,其生产流程可简要表示如下图:
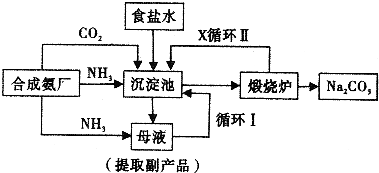
(1)向沉淀池中通入CO2和氨气时,应先通入
(2)沉淀池中发生反应的化学反应方程式是
(3)向母液中通氨气并加入细小食盐颗粒,冷却析出的副产品是
A.增大NH+4的浓度:使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(4)为提高原料氯化钠的利用率,主要是设计了
(5)CO2是制碱工业的重要原料,侯德耪制碱法和氨碱法中CO2的来源有何不同
(6)产品纯碱中含有碳酸氢钠,可以用加热分解的方法测定产品中纯碱的质量分数,已知样品质量为ag,加热至质量不再改变时称重为bg,则纯碱的质量分数为