摘要:8.写出下列反应的离子方程式 (1)用胃舒平治疗胃酸过多. (2)用双氧水将某酸性溶液中的Fe2+转化成Fe3+. (3)水玻璃(Na2SiO3的水溶液)与NH4Cl溶液混合制各种模型. (4)乙烯使酸性高锰酸钾溶液褪色. (5)用食醋除水壶中的水垢(CaCO3). (6)向含0.1 mol NaAlO2的溶液中滴加20 mL 8 mol/L的HCl(aq)的离子方程式为 . (7)含0.1 mol Ca(HCO3)2的溶液中逐滴加入100 mL 1.5 mol/L的NaOH溶液的离子方程式为 . (8)向Mg(HCO3)2溶液中滴加过量的NaOH溶液.离子反应方程式为 . (9)向含0.1 mol FeI2的溶液中滴加含0.12 mol Br2的溴水.离子反应方程式为 . 解析:(1)胃舒平主要成分Al(OH)3.胃酸主要成分HCl. (2)H2O2将Fe2+氧化.还原产物是H2O. (3)SiO32-与NH4+发生双水解反应生成H2SiO3沉淀. (4)C2H4被氧化成CO2.碳元素从-2价升高到+4价. (5)CH3COOH与CaCO3反应.生成的醋酸钙是强电解质且可溶. (6)n(AlO2-)=0.1 mol.n(H+)=0.16 mol.反应过程可认为是①AlO2-+H++H2O===Al(OH)3↓. ②Al(OH)3+3H+===Al3++3H2O.所以该反应离子方程式为:5AlO2-+8H++2H2O===Al3++4Al(OH)3. (7)该反应过程可认为:Ca2++HCO3-+OH-===CaCO3↓+H2O.HCO3-+OH-===CO32-+H2O.所以该反应离子方程式为:2Ca2++3HCO3-+3OH-===2CaCO3↓+3H2O+CO32-. (8)注意MgCO3的溶解度比Mg(OH)2的大.因而该反应离子方程式为:Mg2+ +2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O. (9)因为还原性I->Fe2+.且Br2也能氧化Fe2+.首先I-全部被氧化后.Br2再氧化 Fe2+.该反应离子方程式为:2Fe2++10I-+6Br2===2Fe3++5I2+12Br-. 答案:3+3H+===Al3++3H2O (2)H2O2+2Fe2++2H+===2Fe3++2H2O (3)SiO32-+2NH4++2H2O===H2SiO3↓+2NH3·H2O (4)5C2H4+12MnO4-+36H+===12Mn2++10CO2+28H2O (5)2CH3COOH+CaCO3===2CH3COO-+Ca2++H2O+CO2↑ (6)5AlO2-+8H++2H2O===Al3++4Al(OH3)↓ (7)2Ca2++3HCO3-+3OH-===2CaCO3+3H2O+CO32- (8)Mg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O (9)2Fe2++10I-+6Br2===2Fe3++5I2+12Br- 考点3 化学反应中能量变化规律.热化学方程式的书写及正误判断
网址:http://m.1010jiajiao.com/timu3_id_80992[举报]
写出下列反应的离子方程式:
(1)铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2中加入铜屑可以逐渐溶解,该反应的离子方程式:
(2)脱去天然气中的硫化氢既能减少环境污染,又可回收硫资源.其中硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为:
查看习题详情和答案>>
(1)铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2中加入铜屑可以逐渐溶解,该反应的离子方程式:
H2O2+Cu+2H+=Cu2++2H2O
H2O2+Cu+2H+=Cu2++2H2O
.(2)脱去天然气中的硫化氢既能减少环境污染,又可回收硫资源.其中硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为:
2Fe3++H2S=S+2Fe2++2H+
2Fe3++H2S=S+2Fe2++2H+
.完成下列填空:
A.将下列化学方程式改写成离子方程式,离子方程式改写成化学方程式:
(1)Na2CO3+2HCl═2NaCl+CO2↑+H2O
(2)Fe+Cu2+═Fe2++Cu
B.写出下列反应的离子方程式
(1)实验室用锌与稀硫酸反应制氢气:
(2)盐酸溶液与氢氧化钠溶液:
(3)稀硫酸与氢氧化钡溶液:
查看习题详情和答案>>
A.将下列化学方程式改写成离子方程式,离子方程式改写成化学方程式:
(1)Na2CO3+2HCl═2NaCl+CO2↑+H2O
CO32-+2H+=CO2↑+H2O
CO32-+2H+=CO2↑+H2O
;(2)Fe+Cu2+═Fe2++Cu
Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
.B.写出下列反应的离子方程式
(1)实验室用锌与稀硫酸反应制氢气:
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
;(2)盐酸溶液与氢氧化钠溶液:
H++OH-=H2O
H++OH-=H2O
;(3)稀硫酸与氢氧化钡溶液:
2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O
2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O
.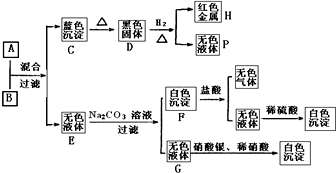 将碱溶液A、盐溶液B按如下程度进行实验,根据下述现象判断:
将碱溶液A、盐溶液B按如下程度进行实验,根据下述现象判断:(1)A的化学式
Ba(OH)2
Ba(OH)2
; B的化学式CuCl2
CuCl2
.(2)完成下列转化的化学方程式,并用“单线桥法”标明电子转移的方向和数目:
D→H+P:


(3)写出下列反应的离子方程式:
A+B:
Cu2++2OH-=Cu(OH)2↓
Cu2++2OH-=Cu(OH)2↓
F+盐酸:
BaCO3+2H+=Ba2++CO2↑+H2O
BaCO3+2H+=Ba2++CO2↑+H2O
(4)盐溶液B中阴离子的检验方法是
取少量B溶液于试管中,滴加硝酸银溶液产生白色沉淀,再滴加稀硝酸沉淀不溶解
取少量B溶液于试管中,滴加硝酸银溶液产生白色沉淀,再滴加稀硝酸沉淀不溶解
.写出下列反应的离子方程式:
(1)过氧化钠溶于水
(2)苏打溶液中滴入少量盐酸
(3)MnO2与浓盐酸共热
(4)向NaHSO4溶液中逐滴加入Ba (OH)2溶液至溶液呈中性
查看习题详情和答案>>
(1)过氧化钠溶于水
2Na2O2+2H2O═4Na++4OH-+O2↑
2Na2O2+2H2O═4Na++4OH-+O2↑
;(2)苏打溶液中滴入少量盐酸
CO32-+H+═HCO3-
CO32-+H+═HCO3-
;(3)MnO2与浓盐酸共热
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
;
| ||
(4)向NaHSO4溶液中逐滴加入Ba (OH)2溶液至溶液呈中性
2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O
2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O
;在以上中性溶液中,继续滴加Ba(OH)2溶液Ba2++SO42-═BaSO4↓
Ba2++SO42-═BaSO4↓
.方程式的书写
(1)写出下列反应的离子方程式
①氢氧化钠溶液和硫酸铜溶液的反应
②碳酸钙和稀盐酸的反应
③铁与硫酸铜溶液反应
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①Mg+2H+=Mg2++H2↑
②HC
+H+=CO2↑+H2O
③Fe3++3OH-=Fe(OH)3↓
查看习题详情和答案>>
(1)写出下列反应的离子方程式
①氢氧化钠溶液和硫酸铜溶液的反应
Cu2++2OH-=Cu(OH)2↓
Cu2++2OH-=Cu(OH)2↓
②碳酸钙和稀盐酸的反应
CaCO3+2H+═Ca2++H2O+CO2↑
CaCO3+2H+═Ca2++H2O+CO2↑
③铁与硫酸铜溶液反应
Fe+Cu2+=Fe2++Cu
Fe+Cu2+=Fe2++Cu
(2)根据下列离子方程式,各写一个符合条件的化学方程式
①Mg+2H+=Mg2++H2↑
Mg+2HCl=MgCl2+H2↑
Mg+2HCl=MgCl2+H2↑
②HC
| O | - 3 |
NaHCO3+HCl=NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
③Fe3++3OH-=Fe(OH)3↓
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
.