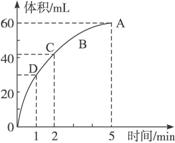
摘要: 加入0.1 mol MnO2粉末于50 mL过氧化氢溶液(ρ=1.1 g·mL-1)中.在标准状况下放出气体的体积和时间的关系如图所示. (1)实验时放出气体的总体积是 . (2)放出一半气体所需的时间为 . (3)反应放出气体所需时间为 . (4)A.B.C.D各点反应速率快慢的顺序为 . (5)解释反应速率变化的原因 . (6)计算H2O2的初始物质的量的浓度 . (7)求反应到2 min时.H2O2的质量分数 . 解析:根据V-t图像知.反应进行至1 min时.放出O2的体积为30 mL.反应进行至2 min时.放出O2的体积为45 mL.反应进行至4 min时.放出O2的体积达最大值60 mL,由V-t曲线的斜率变化可知:D.C.B.A的反应速率逐渐减小.这是因为随着反应的进行.c(H2O2)逐渐降低.反应速率逐渐变小,根据:2H2O22H2O+O2↑.由V(O2)=60 mL.则n(H2O2)=×2=0.005 4 mol.所以H2O2的起始物质的量浓度为=0.107 mol/L.反应进行至2 min时.V(O2)=45 mL.消耗H2O2的物质的量为×2=0.004 mol.剩余H2O2的物质的量为0.005 4 mol-0.004 mol=1.40×10-3 mol. 所以w(H2O2)==0.086%. 答案:2 min (4)D>C>B>A (5)随着反应的进行.c(H2O2)逐渐降低.反应速率逐渐变慢 0.086%
网址:http://m.1010jiajiao.com/timu3_id_80832[举报]
加入0.1 mol MnO2粉末于50 mL过氧化氢溶液(ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
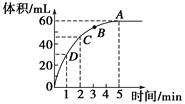
(1)反应放出![]() 气体所需时间为_____________
气体所需时间为_____________
(2)A、B、C、D各点反应速率快慢的顺序为_____________
(3)计算H2O2的初始物质的量浓度_____________
(4)求反应到2 min时,H2O2的质量分数_____________

加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g ·mL-1),在标准状况下放出气体的体积和时间的关系如图2-7所示,完成下列问题:
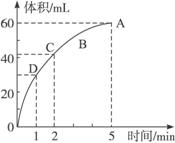
图2-7
(1)实验时放出气体的总体积为_________________。
(2)放出一半气体所需要的时间为_________________。
(3)反应放出3/4气体所需要的时间为_________________。
(4)A、B、C、D四点化学反应速率快慢的顺序为_________________。
查看习题详情和答案>>
加入0.1 mol的MnO2粉末于50 mL过氧化氢的溶液中(密度为1.1 g ·mL-1),在标准状况下放出气体的体积和时间的关系如下图所示,请完成下列问题:
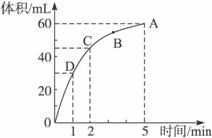
(1)实验时放出气体的总体积为______________。
(2)放出一半气体所需要的时间为______________。
(3)反应放出3/4气体所需要的时间为______________。
(4)A、B、C、D四点化学反应速率由快到慢的顺序为______________。
查看习题详情和答案>>