摘要:将4个数排成2行.2列.两边各加一条竖直线记成.定义.上述记号就叫做2阶行列式.若. .
网址:http://m.1010jiajiao.com/timu3_id_8013[举报]
在探究某物质的组成活动中,某实验小组的同学将3.2g某物质在氧气中充分燃烧后,得到了8.8g二氧化碳和7.2g的水.根据实验结果分析时,同学们得出了下列多项结论,你认为其中正确的是( )
①该物质一定含有C、H,不含O
②该物质一定含有C、H,可能含O
③该物质分子中C、H的原子个数比为1:2
④该物质分子中C、H的原子个数比为1:4.
①该物质一定含有C、H,不含O
②该物质一定含有C、H,可能含O
③该物质分子中C、H的原子个数比为1:2
④该物质分子中C、H的原子个数比为1:4.
| A、②、③ | B、②、④ | C、①、③ | D、①、④ |
如图是部分元素原子结构示意图:
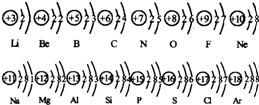
根据如图,可以总结出“同一纵行的元素,原子最外层上的电子数相同”的规律.你还能总结出哪些规律,试将它们分别加以表述(你认为有几条就写几条,可以不填满):
(1)
(2)
(3)
(4)
(5)
查看习题详情和答案>>

根据如图,可以总结出“同一纵行的元素,原子最外层上的电子数相同”的规律.你还能总结出哪些规律,试将它们分别加以表述(你认为有几条就写几条,可以不填满):
(1)
同一横行元素的原子,核外电子层数相同
同一横行元素的原子,核外电子层数相同
(2)
同一横行从左到右,最外层电子数从1逐渐递增到8
同一横行从左到右,最外层电子数从1逐渐递增到8
(3)
同一横行从左到右,核电荷数逐渐增大
同一横行从左到右,核电荷数逐渐增大
(4)
同一纵行从上到下,电子层数逐渐增加
同一纵行从上到下,电子层数逐渐增加
(5)
同一纵行的元素原子的最外层的电子数相同
同一纵行的元素原子的最外层的电子数相同
.28、随着经济的发展,能源与环境成为人们日益关注的问题.(1)化石燃料主要包括煤、
(2)化石燃料燃烧都会产生二氧化碳,它是空气中含量最多的温室气体.自然界中消耗二氧化碳的主要途径是
(3)低碳经济是一种以低能耗和高效能等为主要特征,以较少的温室气体排放获得较大产出的新经济发展模式.下列发电形式符合“低碳经济”理念的是(填数字序号)
①水力发电 ②风力发电 ③天然气发电 ④太阳能发电 ⑤垃圾焚烧发电
(4)二氧化碳是导致温室效应的主要气体,同时,它也是一种宝贵的碳氧资源.
以CO2和NH3合成尿素CO(NH2)2是固定和利用CO2的成功范例,该反应需在高温高压下进行,同时有水生成,写出反应的化学方程式
(5)人类发明并使用氟利昂(主要用做致冷剂)若干年后,科学家发现氟利昂在紫外线照射下分解得到的氯原子能破坏臭氧层,其破坏臭氧层的循环示意图如图所示:

请回答:在以上臭氧分子被破坏的过程中,氯原子所起的作用是
查看习题详情和答案>>
天然气
、石油.(2)化石燃料燃烧都会产生二氧化碳,它是空气中含量最多的温室气体.自然界中消耗二氧化碳的主要途径是
光合作用
.(3)低碳经济是一种以低能耗和高效能等为主要特征,以较少的温室气体排放获得较大产出的新经济发展模式.下列发电形式符合“低碳经济”理念的是(填数字序号)
①②④
.①水力发电 ②风力发电 ③天然气发电 ④太阳能发电 ⑤垃圾焚烧发电
(4)二氧化碳是导致温室效应的主要气体,同时,它也是一种宝贵的碳氧资源.
以CO2和NH3合成尿素CO(NH2)2是固定和利用CO2的成功范例,该反应需在高温高压下进行,同时有水生成,写出反应的化学方程式
CO2+2NH3═CO(NH2)2+H2O
.(5)人类发明并使用氟利昂(主要用做致冷剂)若干年后,科学家发现氟利昂在紫外线照射下分解得到的氯原子能破坏臭氧层,其破坏臭氧层的循环示意图如图所示:

请回答:在以上臭氧分子被破坏的过程中,氯原子所起的作用是
催化
;实验室还可将氧气通过高压放电管来制取臭氧.若在反应中有30%的氧气转化为臭氧,则所得混合气中氧气与臭氧的分子个数比为7:2
.(2012?昆明)(1)如图1所示a、b、c、d四个点,表示可燃物容易着火的点是
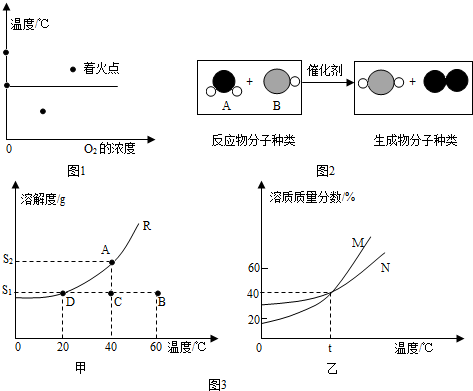
(2)请根据如图2反应的微观示意图分析:
参加反应的化合物A与化合物B的分子个数比为
(3)将一定质量的氯酸钾(不含催化剂)置于试管中加热一段时间,冷却后测得所得固体
中氯元素的质量分数为35.5%,则反应中已分解的氯酸钾的质量分数为
(4)请根据图3所示回答问题:
①甲图中R物质在室温(20℃)时的饱和状态为D点,40℃时的饱和状态为A点,现将甲图中的R溶液从A状态变到B状态,请设计并简述两个简单的实验操作途径:a.
②乙图是表示M、N两种物质饱和溶液的溶质质量分数随温度变化的曲线.现分别向50g M、80g N固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,冷却至t℃,下列分析正确的是
a.只有N析出晶体; b.M、N两种溶液的溶质质量分数相等;
c.只有M析出晶体; d.M、N均有晶体析出;
e.M、N两种物质的溶解度相同.
查看习题详情和答案>>
d
d
点(填字母序号).
(2)请根据如图2反应的微观示意图分析:
参加反应的化合物A与化合物B的分子个数比为
1:2或2:4
1:2或2:4
,生成物中单质分子与化合物分子的个数比为1:4
1:4
.(3)将一定质量的氯酸钾(不含催化剂)置于试管中加热一段时间,冷却后测得所得固体
中氯元素的质量分数为35.5%,则反应中已分解的氯酸钾的质量分数为
46.8
46.8
%.(4)请根据图3所示回答问题:
①甲图中R物质在室温(20℃)时的饱和状态为D点,40℃时的饱和状态为A点,现将甲图中的R溶液从A状态变到B状态,请设计并简述两个简单的实验操作途径:a.
可先将R溶液从A状态稀释到C状态,再将温度升高到60℃
可先将R溶液从A状态稀释到C状态,再将温度升高到60℃
;b.可先将A状态的R溶液温度降低到20℃,过滤后再将滤液温度升高到60℃
可先将A状态的R溶液温度降低到20℃,过滤后再将滤液温度升高到60℃
;c.A状态由两种不同途径变到B状态时,溶液的溶质质量分数是否相等是
是
(填“是”或“否”).②乙图是表示M、N两种物质饱和溶液的溶质质量分数随温度变化的曲线.现分别向50g M、80g N固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,冷却至t℃,下列分析正确的是
ae
ae
(填序号,多选、少选、错选均不给分).a.只有N析出晶体; b.M、N两种溶液的溶质质量分数相等;
c.只有M析出晶体; d.M、N均有晶体析出;
e.M、N两种物质的溶解度相同.