网址:http://m.1010jiajiao.com/timu3_id_80052[举报]
(1)写出用KMnO4滴定H2C2O4的离子方程式______________________________________。
(2)判断滴定终点的方法是____________________________________________________。
(3)计算:血液中含钙离子的浓度为__________________g·mL-1。
查看习题详情和答案>>CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol/L的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________________________。
(2)判断滴定终点的方法是________________________。
(3)计算:血液中含钙离子的浓度为________g·mL-1。
(1)写出用KMnO4滴定H2C2O4的离子方程式_________________________。
(2)判断滴定终点的方法是__________________________________。
(3)计算:血液中含钙离子的浓度为__________________g·mL-1。
Ca2++C2O![]() ====CaC2O4↓ CaC2O4+H2SO4====CaSO4+H2C2O4
====CaC2O4↓ CaC2O4+H2SO4====CaSO4+H2C2O4
2KMnO4+5H2C2O4+3H2SO4====K2SO4+2MnSO4+10CO2↑+8H2O
现量取10.00 mL血样,用上述方法测定血钙含量时,耗用0.1200 mol·L-1 KMnO4溶液5.0 mL恰好达滴定终点,则此血样中的含钙量为( )
A.2.40 g·L-1 B.3.00 g·L-1
C.6.00 g·L-1 D.4.80 g·L-1
查看习题详情和答案>>人体血液里Ca2+的浓度一般采用g/cm3来表示(即1 cm3血样中含有的Ca2+的质量)。抽取 一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
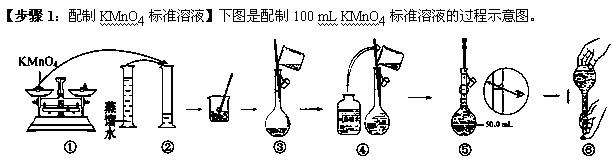 (1)请你观察图示判断,其中不正确的两项操作有 (填序号);
(1)请你观察图示判断,其中不正确的两项操作有 (填序号);
(2)其中确定100 mL溶液体积的仪器是__________________
(3)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将
______(填“偏大”或“偏小”)。
【步骤2:测定血液样品中Ca2+的浓度】抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L 酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)写出草酸与酸性KMnO4溶液反应的离子方程式 。
(5)滴定的终点为 。
(6)经过计算,血液样品中Ca2+的浓度为__________g/cm3。
查看习题详情和答案>>