网址:http://m.1010jiajiao.com/timu3_id_80047[举报]
MmAn(s)═mMn+(aq)+nAm-(aq)
Ksp=cm(Mn+)?cn(Am-),称为溶度积.
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
| 难溶电解质 | CaCO3 | CaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 9.1×10-6 | 6.8×10-6 | 1.8×10-11 |
①往100mL 0.1mol?L-1的CaCl2溶液中加入100mL 0.1mol?L-1的Na2SO4溶液,立即有白色沉淀生成.
②向上述悬浊液中加入固体Na2CO3 3g,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④
(1)由题中信息Ksp越大,表示电解质的溶解度越
(2)写出第②步发生反应的化学方程式:
(3)设计第③步的目的是
(4)请补充第④步操作及发生的现象:
(8分)已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s)  mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=[c(Mn+)]m×[c(Am-)]n 称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
| 难溶电解质 | CaCO3 | CaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 9.1×10-6 | 6.8×10-6 | 1.8×10-12 |
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④_____________________________________________________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越 (填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:______________________________________。
(3)设计第③步的目的是___________________________________________________。
(4)请补充第④步操作及发生的现象: _____。 查看习题详情和答案>>
(8分)已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s) 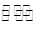 mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=[c(Mn+)]m×[c(Am-)]n 称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
|
难溶电解质 |
CaCO3 |
CaSO4 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
2.8×10-9 |
9.1×10-6 |
6.8×10-6 |
1.8×10-12 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④_____________________________________________________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越 (填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:______________________________________。
(3)设计第③步的目的是___________________________________________________。
(4)请补充第④步操作及发生的现象: _____。
查看习题详情和答案>>
已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s) mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=c(Mn+)m·c(Am-)n,称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
|
难溶电解质 |
CaCO3 |
CaSO4 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
2.8×10-9 |
9.1×10-6 |
6.8×10-6 |
1.8×10-11 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol ·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④______________________________________________________________________。
(1)由题中信息Ksp越大,表示电解质的溶解度越________(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:_____________________________。
(3)设计第③步的目的是________________________________________。
(4)请补充第④步操作及发生的现象:_________________________________。
查看习题详情和答案>>
MmAn(s)

 mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)Ksp=cm(Mn+) ·cn(Am-),称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能
 性,查得如下资料:(25 ℃)
性,查得如下资料:(25 ℃)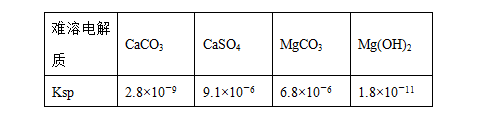
①往100 mL 0.1 mol/L的CaCl2溶液中加入100 mL 0.1 mol/L的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊
 液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④____________________________________________。
(2)写出第②步发生反应的化学方程式: ________________________________。
(3)设计第③步的目的是________________________。
(4)请补充第④步操作及发生的现象: __________________________。