摘要: 常温下.用0.1 mol·L-1的HCl溶液滴定a mL NaOH稀溶液.反应恰好完全时.消耗HCl溶液b mL.此时溶液中氢氧根离子的浓度c(OH-)是( ) A.1×10-7 mol·L-1 B.1×107 mol·L-1 C.0.1b/a mol·L-1 D.0.1b/(a+b) mol·L-1 解析:由于此题是酸碱中和滴定.且是一元强酸与一元强碱的中和.当恰好完全反应时.溶液的pH为7.溶液呈中性.常温下c(H+)=c(OH-)=1×10-7 mol·L-1.故选A. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_80036[举报]
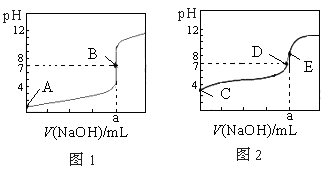
常温下,用 0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是( )


图1 图2
A.图2是滴定盐酸的曲线
B.a与b的关系是:a<b
C.E点对应离子浓度由大到小的顺序为: c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂
查看习题详情和答案>>
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1盐酸和20.00 mL 0.1000 mol·L-1醋酸溶液,得到两条滴定曲线,如下图所示,若以HA表示酸,下列说法正确的是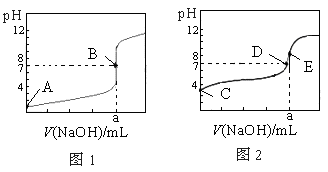
A.滴定盐酸的曲线是图2
B.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
C.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
D.当0 mL<V(NaOH)<20.00 mL时,对应混合液中各离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-)
常温下,用 0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是( )

图1 图2
| A.图2是滴定盐酸的曲线 |
| B.a与b的关系是:a<b |
| C.E点对应离子浓度由大到小的顺序为: c(CH3COO-)> c(Na+)> c(H+)> c(OH-) |
| D.这两次滴定都可以用甲基橙作为指示剂 |