摘要:若该溶液是酸性溶液.必先确定c(H+).再进行PH的计算.若该溶液是碱性溶液.必先确定c(OH-).可根据c(H+)·c(OH-)=Kw换算成c(H+).再求PH.或引用PH定义.由c(OH-)直接求POH.再根据PH+POH=PKw.换算出PH. 例1.求室温下1.0×10-3mol/L的Ba(OH)2溶液的PH. 解析:由题意c(OH-)=2.0×10-3mol/L.c(H+)·c(OH-)=Kw.c(H+)= Kw/ c(OH-)=5.0×10-12mol/L.PH=-lgc(H+)=-lg5.0×10-12=11.3. 或由题意c(OH-)=2.0×10-3mol/L.POH=-lgc(OH-)=-lg2.0×10-3=2.7.PH+POH=PKw.PH+2.7=14.PH=11.3.
网址:http://m.1010jiajiao.com/timu3_id_79470[举报]
现有一瓶浓度为0.1mol/L的某酸溶液,可能为醋酸、盐酸或硫酸中的一种.为了确定该酸溶液的组成进行实验:取20.00mL该酸溶液,从滴定管中逐滴加入0.1mol/L的氢氧化钠溶液.请回答下列问题.
(1)滴加碱液时,控制滴定管活塞的具体操作方法是: .
(2)若所加入碱液的体积略小于20.00mL时,反应后溶液刚好呈中性,该酸是: .用离子方程式表示反应后溶液中存在的所有离子平衡 .
(3)若加入的碱液体积为20mL,证明该酸是盐酸还需进行的实验操作是(请说出必要的操作步骤和实验现象,实验仪器、药品自选) .向盐酸溶液中先加入AgNO3溶液,再加入KI溶液,已知AgCl:Ksp=2×1-10,AgI:Ksp=9×10-16.当两种沉淀共存时,则c(I-) c(C1-)(填“<”、“>”、“=”),有没有可能只得到一种沉淀 (填:“有”、“没有”),请说明理由 .
查看习题详情和答案>>
(1)滴加碱液时,控制滴定管活塞的具体操作方法是:
(2)若所加入碱液的体积略小于20.00mL时,反应后溶液刚好呈中性,该酸是:
(3)若加入的碱液体积为20mL,证明该酸是盐酸还需进行的实验操作是(请说出必要的操作步骤和实验现象,实验仪器、药品自选)
| |||||||||||||||||||||||
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.该法的工艺流程为:
CrO42-
Cr2O72-
Cr3+
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若平衡时溶液呈强酸性,则溶液显
(2)能说明第①步反应达平衡状态的是
A.Cr2O72-和CrO42-的浓度相同 B.溶液的颜色不变
C.CrO42-的消耗速率是Cr2O72-生成速率的2倍 D.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要
(4)Cr(OH)3在水溶液中有两种电离方式,并存在以下平衡:
H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-
下列有关说法中正确的是
a、加酸平衡向右移动,生成Cr3+;加碱平衡向左移动,生成CrO2-
b、在一定条件下存在反应:Cr(OH)3+OH-→CrO2-+2H2O;Cr(OH)3+3H+→Cr3++3H2O
c、Cr3+盐溶液中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中存在三个平衡.
查看习题详情和答案>>
CrO42-
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若平衡时溶液呈强酸性,则溶液显
橙
橙
色(2)能说明第①步反应达平衡状态的是
BD
BD
.A.Cr2O72-和CrO42-的浓度相同 B.溶液的颜色不变
C.CrO42-的消耗速率是Cr2O72-生成速率的2倍 D.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要
0.06
0.06
mol的FeSO4?7H2O.(4)Cr(OH)3在水溶液中有两种电离方式,并存在以下平衡:
H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-
下列有关说法中正确的是
ab
ab
a、加酸平衡向右移动,生成Cr3+;加碱平衡向左移动,生成CrO2-
b、在一定条件下存在反应:Cr(OH)3+OH-→CrO2-+2H2O;Cr(OH)3+3H+→Cr3++3H2O
c、Cr3+盐溶液中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中存在三个平衡.
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.该法的工艺流程为:
CrO42-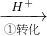 Cr2O72-
Cr2O72-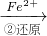 Cr3+
Cr3+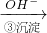 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若平衡时溶液呈强酸性,则溶液显______色
(2)能说明第①步反应达平衡状态的是______.
A.Cr2O72-和CrO42-的浓度相同 B.溶液的颜色不变
C.CrO42-的消耗速率是Cr2O72-生成速率的2倍 D.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要______mol的FeSO4?7H2O.
(4)Cr(OH)3在水溶液中有两种电离方式,并存在以下平衡:
H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-
下列有关说法中正确的是______
a、加酸平衡向右移动,生成Cr3+;加碱平衡向左移动,生成CrO2-
b、在一定条件下存在反应:Cr(OH)3+OH-→CrO2-+2H2O;Cr(OH)3+3H+→Cr3++3H2O
c、Cr3+盐溶液中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中存在三个平衡.
查看习题详情和答案>>
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.该法的工艺流程为:
CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若平衡时溶液呈强酸性,则溶液显 色
(2)能说明第①步反应达平衡状态的是 .
A.Cr2O72-和CrO42-的浓度相同 B.溶液的颜色不变
C.CrO42-的消耗速率是Cr2O72-生成速率的2倍 D.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要 mol的FeSO4?7H2O.
(4)Cr(OH)3在水溶液中有两种电离方式,并存在以下平衡:
H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-
下列有关说法中正确的是
a、加酸平衡向右移动,生成Cr3+;加碱平衡向左移动,生成CrO2-
b、在一定条件下存在反应:Cr(OH)3+OH-→CrO2-+2H2O;Cr(OH)3+3H+→Cr3++3H2O
c、Cr3+盐溶液中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中存在三个平衡. 查看习题详情和答案>>
CrO42-
 Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若平衡时溶液呈强酸性,则溶液显 色
(2)能说明第①步反应达平衡状态的是 .
A.Cr2O72-和CrO42-的浓度相同 B.溶液的颜色不变
C.CrO42-的消耗速率是Cr2O72-生成速率的2倍 D.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要 mol的FeSO4?7H2O.
(4)Cr(OH)3在水溶液中有两种电离方式,并存在以下平衡:
H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-
下列有关说法中正确的是
a、加酸平衡向右移动,生成Cr3+;加碱平衡向左移动,生成CrO2-
b、在一定条件下存在反应:Cr(OH)3+OH-→CrO2-+2H2O;Cr(OH)3+3H+→Cr3++3H2O
c、Cr3+盐溶液中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中存在三个平衡. 查看习题详情和答案>>
 I3-,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=S4O62-+3I-.
I3-,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=S4O62-+3I-.