摘要:选择制备盐的途径时需考虑盐的水解.有些盐(如Al2S3)遇水即水解.无法在溶液中制取.只能由单质直接反应制取,还有些盐(如FeCl3 .AlCl3 )必须在蒸发过程中不断通入HCl气体.以抑制阳离子的水解.才能得到其固体.
网址:http://m.1010jiajiao.com/timu3_id_79446[举报]
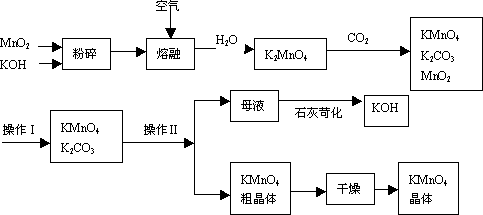
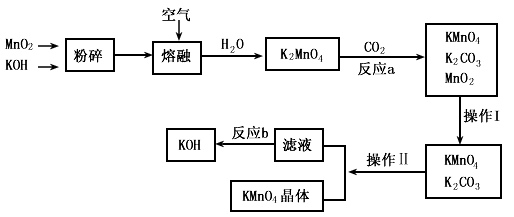
高锰酸钾是锰的重要化合物和常用的氧化剂,工业用软锰矿制备高锰酸钾的实验流程如下:
(1)上述流程中可以循环使用的物质有__________ 、_____________(写化学式)
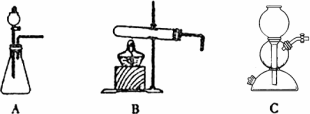
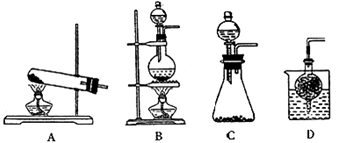
(2)生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择__________ (填试剂代号),可用的发生装置为 __________(填装置代号)。
a.石灰石 b.浓盐酸 c.稀H2SO4 d.纯碱
(2)生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择__________ (填试剂代号),可用的发生装置为 __________(填装置代号)。
a.石灰石 b.浓盐酸 c.稀H2SO4 d.纯碱
(3)操作II是将混合溶液浓缩结晶、趁热过滤、洗涤,可得到KMnO4晶体。证明晶体已洗涤干净的实验操作为____________。
(4)从经济环保角度考虑,要完全反应b需要的试剂最好是___________,并写出相应的化学方程式 ______________。
(5)高锰酸钾是氧化还原滴定分析时常用的一种试剂,在滴定操作时,应将高锰酸钾标准溶液盛放在_____________(填“酸式”或“碱式”)滴定管中,在用容量瓶配制250ml高锰酸钾标准溶液时,需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需__________(填仪器名称)用酸性KMnO4溶液滴定硫酸亚铁晶体(FeSO4·7H2O), 写出滴定反应的离子方程式_____________________ 。
查看习题详情和答案>>
(4)从经济环保角度考虑,要完全反应b需要的试剂最好是___________,并写出相应的化学方程式 ______________。
(5)高锰酸钾是氧化还原滴定分析时常用的一种试剂,在滴定操作时,应将高锰酸钾标准溶液盛放在_____________(填“酸式”或“碱式”)滴定管中,在用容量瓶配制250ml高锰酸钾标准溶液时,需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需__________(填仪器名称)用酸性KMnO4溶液滴定硫酸亚铁晶体(FeSO4·7H2O), 写出滴定反应的离子方程式_____________________ 。
| |||||||||||||||||||||||
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用.某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量.设计的流程如图1:
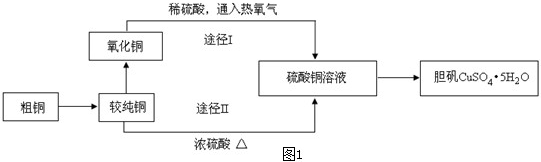
(1)“较纯铜”转化为氧化铜时,应将其置于 内进行灼烧(填写仪器名称).“粗铜”表面的油脂可以用热碱溶液洗去,原因是 .若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜.存在少量铜的可能原因是 .
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥.比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:① ;② .
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是 .
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用如图2装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃.反应前后各装置的质量见表格中所示.
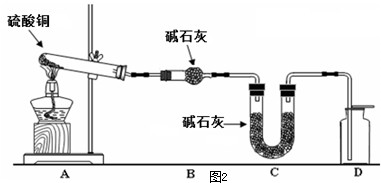
请通过计算,推断该实验条件下硫酸铜分解的化学方程式: .
查看习题详情和答案>>

(1)“较纯铜”转化为氧化铜时,应将其置于
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用如图2装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃.反应前后各装置的质量见表格中所示.
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 50.0g | 70.0g | 540.0g |
| 反应后 | 45.0g | 74.5g | 540.0g |

请通过计算,推断该实验条件下硫酸铜分解的化学方程式:
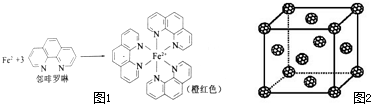 元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.
元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值.(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰.相关的反应如下:
4FeCl3+2NH2OH?HCl→4FeCl2+N2O↑+6HCl+H2O
①Fe2+在基态时,核外电子排布式
②羟胺中(NH2OH)采用SP3杂化的原子有
③Fe2+与邻啡罗啉形成的配合物中,配位数为
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,该晶体中含有的化学键类型是
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3 不易与Cu2+形成配离子,其原因是
(4)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
(5)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周 期电负性最小的原子可作为容体掺入C60 晶体的空隙中,形成具有良好的超导性的掺杂C60 化合物.现把C60抽象成质点,该晶体的晶胞结构如图2所示,若每个四面体空隙填入一个原子,则全部填满C60 晶体的四面体空隙后,所形成的掺杂C60 化合物的化学式为