摘要:1.在一真空密闭的定容容器中放入N2O4晶体并使之气化.当反应N2O42NO2建立平衡 后.再通入一些N2O4气体.待反应再次达到新的平衡.则平衡混合气体中的比值.新平衡与旧平衡相比( ) A.新平衡时大 B.新平衡时小 C.不变 D.无法确定 解析:平衡后.再通入一些N2O4气体.相当于增大压强.平衡向体积减小的方向即逆反应方向移动. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_78936[举报]
在一真空密闭的定容容器中放入N2O4晶体并使之气化,当反应N2O4?2NO2建立平衡后再通入一些N2O4气体(温度不变),待反应达到新的平衡,则平衡混合气体中c(NO2):c(N2O4)比值,新平衡与旧平衡相比( )
查看习题详情和答案>>
在一真空密闭的定容容器中放入N2O4晶体并使之气化,当反应N2O4 2NO2建立平衡 后,再通入一些N2O4气体(温度不变),待反应再次达到新的平衡,则平衡混合气体中 2NO2建立平衡 后,再通入一些N2O4气体(温度不变),待反应再次达到新的平衡,则平衡混合气体中 的比值,新平衡与旧平衡相比 的比值,新平衡与旧平衡相比 |
| [ ] |
| A.新平衡时大 B.新平衡时小 C.不变 D.无法确定 |
 在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
0.0025mol?L-1?min-1
0.0025mol?L-1?min-1
mol?L-1?min-1.(2)n3
=
=
n4(填“>”、“<”或“=”),该反应的平衡常数的值为2.8
2.8
;(3)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是
0.1mol/L
0.1mol/L
mol/L.(4)假设从放入N2O4到平衡时需要80s,请在右图中画出并标明该条件下此反应中N2O4浓度随时间变化的曲线.
(5)在(4)中条件下达到平衡后四氧化二氮的转化率为
60%
60%
,混合气体的平均摩尔质量为57.5
57.5
g.mol-1.(6)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2
 N2O4的平衡常数将
N2O4的平衡常数将减小
减小
(填“增大”、“减小”或“不变”)(7)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡2NO2
 N2O4将
N2O4将向左移动
向左移动
.(填“向左移动”、“向右移动”或“不移动”).(8)达到平衡后,如果缩小容器的体积,则气体的颜色变化是先变深后变浅,但比原来的颜色深,试用平衡移动原理解释其变化的原因
缩小容器体积,压强增大,c(NO2)的浓度变大,颜色加深;增大压强,平衡正向移动,c(NO2)的浓度减小,但比原来的浓度要大,所以看到气体颜色先变深,后变浅,但比原来深.
缩小容器体积,压强增大,c(NO2)的浓度变大,颜色加深;增大压强,平衡正向移动,c(NO2)的浓度减小,但比原来的浓度要大,所以看到气体颜色先变深,后变浅,但比原来深.
.在100℃时,将0.4mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
(1)在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为______mol?L-1?min-1.
(2)n3______n4(填“>”、“<”或“=”),该反应的平衡常数的值为______;
(3)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是______mol/L.
(4)假设从放入N2O4到平衡时需要80s,请在右图中画出并标明该条件下此反应中N2O4浓度随时间变化的曲线.
(5)在(4)中条件下达到平衡后四氧化二氮的转化率为______,混合气体的平均摩尔质量为______g.mol-1.
(6)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2
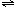
N2O4的平衡常数将______(填“增大”、“减小”或“不变”)
(7)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡2NO2
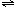
N2O4将______.(填“向左移动”、“向右移动”或“不移动”).
(8)达到平衡后,如果缩小容器的体积,则气体的颜色变化是先变深后变浅,但比原来的颜色深,试用平衡移动原理解释其变化的原因______.
查看习题详情和答案>>
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
(2)n3______n4(填“>”、“<”或“=”),该反应的平衡常数的值为______;
(3)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是______mol/L.
(4)假设从放入N2O4到平衡时需要80s,请在右图中画出并标明该条件下此反应中N2O4浓度随时间变化的曲线.
(5)在(4)中条件下达到平衡后四氧化二氮的转化率为______,混合气体的平均摩尔质量为______g.mol-1.
(6)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2
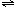
N2O4的平衡常数将______(填“增大”、“减小”或“不变”)
(7)达到平衡后,如向该密闭容器中再充入0.32molHe气,并把容器体积扩大为4L,则平衡2NO2
N2O4将______.(填“向左移动”、“向右移动”或“不移动”).
(8)达到平衡后,如果缩小容器的体积,则气体的颜色变化是先变深后变浅,但比原来的颜色深,试用平衡移动原理解释其变化的原因______.

(创新预测题)(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
请回答下列问题:
①表中a=______,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为_________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l) H4SiO4(aq) ΔH
H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:________________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是______________________________________。
 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:| t/s c/(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)/(mol·L-1) | 0.100 | a | 0.5b | 0.4b | | |
| c(NO2)/(mol·L-1) | 0 | 0.060 | b | c1 | c2 | c3 |
请回答下列问题:
①表中a=______,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为_________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l)
 H4SiO4(aq) ΔH
H4SiO4(aq) ΔH①写出该反应的化学平衡常数K的表达式:________________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是______________________________________。