摘要: (2010·模拟精选.北京东城模拟)200℃时.11.6 g由CO2和H2O组成的混合气体与足 量Na2O2充分反应后.固体质量增加3.6 g,则原混合气体的平均摩尔质量为(g·mol-1) A.5.8 B.11.6 C.23.2 D.46.4 解析:本题属于有关混合物的计算题,设气体混合物中CO2的物质的量为x mol, H2O的物质的量为y mol.
网址:http://m.1010jiajiao.com/timu3_id_78521[举报]
200 ℃?时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应,反应后固体的质量增加了3.6 g。则原混合气体的平均相对分子质量为( )
A.5.8 B.11.6?
C.23.2 D.46.4
查看习题详情和答案>>200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为( )
A.5.8 B.11.6 C.23.2 D.46.4
查看习题详情和答案>>
200℃时,11.6 g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6 g,再将反应后剩余固体冷却后加入含有 、
、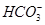 、
、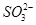 、
、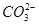 等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )
等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是 ( )
| A.原混合气体的平均摩尔质量为23.2 g/mol |
| B.混合气体与Na2O2反应过程中电子转移的物质的量为0.25 mol |
C.溶液中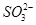 的物质的量浓度基本保持不变 的物质的量浓度基本保持不变 |
D.溶液中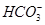 的物质的量浓度减小, 的物质的量浓度减小,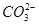 的物质的量浓度增大,但是 的物质的量浓度增大,但是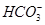 和 和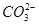 的物质的量浓度之和基本保持不变 的物质的量浓度之和基本保持不变 |