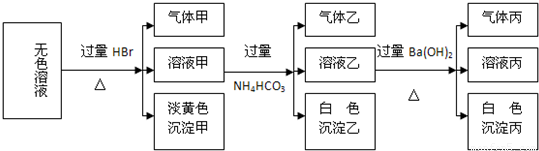
摘要:17.某无色溶液.其中可能存在的离子如下:Na+.Ag+.Ba2+.Al3+.[Al(OH)4]-.S2-.CO.SO.SO.现取该溶液进行有关实验.有如下结果.试回答有关问题 (1)沉淀甲是 .生成沉淀甲的离子方程式为 . (2)沉淀乙是 .由溶液甲生成沉淀乙的离子方程式为 . (3)沉淀丙是 .如何用一化学实验来确定其成分? . (4)综合上述信息.溶液中可以肯定存在的离子有 . 解析:确定沉淀甲较为关键.若甲是AgBr.即溶液中含Ag+.则所有阴离子均不可能大量存在.转而分析的是S2-.SO与H+反应生成S.从而使思路畅通. 答案:(1)S 2S2-+SO+6H+===3S↓+3H2O 3 Al3++3HCO===Al(OH)3↓+3CO2↑ (3)一定有BaCO3.还可能有BaSO4 向沉淀丙中加入过量的稀盐酸.若沉淀不能完全溶解.说明其中有BaSO4 (4)S2-.SO.[Al(OH)4]-.Na+
网址:http://m.1010jiajiao.com/timu3_id_78512[举报]
某无色溶液,其中可能存在的离子有:Na+、Ag+、Fe3+、Ba2+、Al3+、AlO2-、S2-、SO32-、SO42-,现取该溶液进行实验,实验结果如下:

(1)生成沉淀甲的离子方程式为
(2)由溶液甲生成沉淀乙的离子方程式为
(3)沉淀丙可能是
(4)综合上述信息,可以肯定存在的离子有
查看习题详情和答案>>

(1)生成沉淀甲的离子方程式为
2S2-+SO42-+6H+=3S↓+3H2O
2S2-+SO42-+6H+=3S↓+3H2O
(2)由溶液甲生成沉淀乙的离子方程式为
Al3++3HCO3-=Al(OH)3↓+3CO2↑
Al3++3HCO3-=Al(OH)3↓+3CO2↑
(3)沉淀丙可能是
BaCO3或BaCO3和BaSO4
BaCO3或BaCO3和BaSO4
(填化学式)(4)综合上述信息,可以肯定存在的离子有
AlO2-、S2-、SO32-、Na+
AlO2-、S2-、SO32-、Na+
.
某无色溶液,其中可能存在的离子如下:Ag+、Na+、Ba2+、Al3+、AlO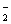 、S2-、CO
、S2-、CO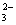 、SO
、SO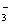 、SO
、SO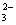 。现取该溶液进行有关实验,实验结果如下图所示:?
。现取该溶液进行有关实验,实验结果如下图所示:?

请完成下列问题:?
(1)沉淀甲是? ?,生成沉淀甲的离子方程式为 。?
(2)沉淀乙是? ?,由沉淀甲生成沉淀乙的离子方程式为 。?
(3)沉淀丙是? ?,如何用一化学实验来确定其成分? 。?
(4)气体甲的成分有哪几种可能? 。?
(5)综合上述信息,可以肯定存在的离子有 。
查看习题详情和答案>>某无色溶液,其中可能存在的离子有:Na+、Ag+、Fe3+、Ba2+、Al3+、AlO2-、S2-、 SO32-、SO42-,现取该溶液进行实验,实验结果如下:

(1)生成沉淀甲的离子方程式为__________________________________________
(2)由溶液甲生成沉淀乙的离子方程式为_________________________________
(3)沉淀丙可能是_____________(填化学式)
(4)综合上述信息,可以肯定存在的离子有__________________
查看习题详情和答案>>
(2)由溶液甲生成沉淀乙的离子方程式为_________________________________
(3)沉淀丙可能是_____________(填化学式)
(4)综合上述信息,可以肯定存在的离子有__________________