摘要: 25℃.101kPa下.碳.氢气.甲烷和葡萄糖的燃烧热依次是393.5kJ/mol.285.8 kJ/mol.890.3 kJ/mol.2800 kJ/mol.则下列热化学方程式正确的是( ) A.C(s)+O2,△H=-393.5kJ/mol B.2H2(g)+O2(g)===2H2O(g) ,△H=+571.6kJ/mol C.CH4(g)+2O2(g)=== CO2(g) +2H2O(g) ,△H=-890.3kJ/mol D.C6H12O6(s)+3O2(g)=== 3CO2(g) +3H2O(l) ,△H=-1400kJ/mol 答案 D 命题意图:考察学生对化学反应中能量变化的理解.以及热化学方程式的书写. 思路点拨:本题错选大多为A.C.原因为未能正确理解燃烧热概念中生成稳定氧化物的含义.CO2是C的稳定氧化物.生成的H2O应该是液态的.
网址:http://m.1010jiajiao.com/timu3_id_77855[举报]
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是△H=-393.5kJ/mol、△H=-285.8kJ/mol、△H=-890.3kJ/mol、△H=-2800kJ/mol,则下列热化学方程式正确的是( )
A、C(s)+
| ||
| B、2H2(g)+O2(g)?2H2O(l)△H=-571.6 kJ/mol | ||
| C、CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=-890.3 kJ/mol | ||
D、
|
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5kJ/mol、ΔH=-285.8kJ/mol、ΔH=-890.3kJ/mol、ΔH=-2800kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+ O2(g)===CO(g)ΔH=-393.5kJ/mol O2(g)===CO(g)ΔH=-393.5kJ/mol |
| B.2H2(g)+O2(g)===2H2O(g)ΔH=+571.6kJ/mol |
| C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3kJ/mol |
D. C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l)ΔH=-1400kJ/mol C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l)ΔH=-1400kJ/mol |
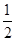 O2(g)===CO(g)ΔH=-393.5kJ/mol
O2(g)===CO(g)ΔH=-393.5kJ/mol