摘要:将容积为50mL的量筒内充满NO2和O2的混合气体.倒置在盛满水的水槽里一段时间后.量筒里剩余气体体积为5mL.则原混合气体中NO2和O2体积比可能是 和 . 第四节 氨 硝酸 硫酸
网址:http://m.1010jiajiao.com/timu3_id_76622[举报]
已知氯水中有如下平衡:Cl2+H2O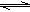 HCl+HClO,常温下在一个容积为50mL的针筒(如图,活塞可自由滑动,针筒上刻有刻度)里吸入40mLCl2和10mLH2O。
HCl+HClO,常温下在一个容积为50mL的针筒(如图,活塞可自由滑动,针筒上刻有刻度)里吸入40mLCl2和10mLH2O。
(1)针筒中可观察到的现象是___
________________。
(2)若将此针筒长时间放置在有日光的地方,最终可观察到的现象是_____________。
(3)用化学平衡的观点解释上题中的现象:_____
_________________________________。
(4)在该针筒内吸入NO2和N2O4的混合气体,如果将活塞迅速往上推,对气体进行压缩,观察到的现象为________________;如果将活塞迅速向下拉,观察到的现象为___________________。

 (2013?闵行区二模)研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(2013?闵行区二模)研究NO2、SO2、CO等大气污染气体的处理具有重要意义.I.利用反应:6NO2+8NH3
| 催化剂 | △ |
II.一定条件下NO2与SO2可发生反应,方程式:NO2(g)+SO2(g)?SO3(g)+NO(g)-Q.
III.CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)?CH3OH(g).
(1)对于I中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2)=
0.015mol/(L?min)
0.015mol/(L?min)
.(2)对于II中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是
bc
bc
(选填编号).a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2和SO3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
(3)如果Ⅱ中反应的平衡常数K值变大,该反应
a
a
(选填编号).a.一定向正反应方向移动 b.平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动 d.平衡移动时,逆反应速率先增大后减小
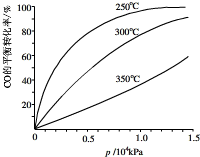
(4)对于Ⅲ中的反应,CO在不同温度下的平衡转化率与压强的关系如图示.该反应是
放热
放热
反应(填“放热”或“吸热”).实际生产条件控制在250℃、1.3×104kPa左右,简述选择此压强的理由:在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
.下列对实验操作的叙述错误的是( )
| A、用胶头滴管加液时,不能伸入试管中 | B、蒸馏盛在烧瓶中含水的酒精,需在瓶内放一些碎瓷片 | C、温度计插入液体中测量温度的同时,又用它搅拌液体 | D、用容积为100mL的量筒量取80mL无水乙醇,使液面最低点至刻度80mL处 |
 在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题:
在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题: M
M