摘要: (化学人教必修1 P88.14题)实验室里通常用MnO2与浓盐酸反应制取氯气.其反应的化学方程式为MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O 为进行有关氯气的性质实验.需要4瓶容积为100 mL的氯气.(室温下.氯气的密度为2.91 g/L.) (1)制取4瓶氯气.理论上需要MnO2固体的质量是多少?(浓盐酸过量.并可以补充.) (2)实际称量的MnO2固体的质量必须适当多于理论量.主要原因是什么? 第三节 硫和氮的氧化物
网址:http://m.1010jiajiao.com/timu3_id_76605[举报]
实验室里通常用MnO2与浓盐酸反应制取氯气.现用下列有关装置先制取干燥、纯净的氯气.后进行有关性质实验.试根据下列有关装置回答有关问题.

(1)上述装置中各仪器从左至右的连接顺序为A接
(2)E装置的作用是
(3)写出相关反应的离子方程式:A中
(4)在制取氯气的反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O中,如转移电子的物质的量是4mol,则被氧化的HCl的物质的量是
(5)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是
(6)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你的化学知识分析,原因是(用离子方程式表示)
查看习题详情和答案>>

(1)上述装置中各仪器从左至右的连接顺序为A接
E
E
接F
F
接C
C
接D
D
接B
B
接G.(2)E装置的作用是
除去氯化氢
除去氯化氢
,D中的现象为湿润的红色布条褪色
湿润的红色布条褪色
,B中的现象为溶液由无色变为褐色.
溶液由无色变为褐色.
(3)写出相关反应的离子方程式:A中
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
,B中
| ||
2I-+Cl2=I2+2Cl-
2I-+Cl2=I2+2Cl-
,G中Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(4)在制取氯气的反应:MnO2+4HCl(浓)
| ||
4
4
mol,有2
2
mol Cl2生成.(5)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是
4Cl2+8NaOH═6NaCl+NaClO3+NaClO+4H2O
4Cl2+8NaOH═6NaCl+NaClO3+NaClO+4H2O
.(6)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你的化学知识分析,原因是(用离子方程式表示)
Cl-+ClO-+2H+═Cl2↑+H2O
Cl-+ClO-+2H+═Cl2↑+H2O
.
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(1)在该反应中,如有1mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol.
(2)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你的化学知识分析,原因是(用离子方程式表示) .
查看习题详情和答案>>
| ||
(1)在该反应中,如有1mol Cl2生成,被氧化的HCl的物质的量是
(2)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件.试根据你的化学知识分析,原因是(用离子方程式表示)
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
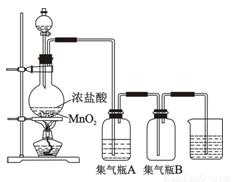
试回答下列问题:
(1)该反应是氧化还原反应吗?① (填“是”或“不是”),如果是氧化还原反应,指出②氧化剂是 ,③还原剂是 ,④写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯
化氢在饱和食盐水中的溶解度则很大),其作用是 。
(3)氯气溶于水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中
毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
(4)一次实验中,加入浓盐酸200mL,其密度为1.19g·cm-3、HCl的质量分数为36.5%,
当MnO2刚好完全反应时,产生了5.6L(标准状况)的氯气。
试计算该浓盐酸的物质的量浓度和被氧化的HCl的物质的量。(请写出计算过程)
查看习题详情和答案>>