题目内容
(共12分)实验室里通常用MnO2与浓盐酸在加热的条件下反应制取氯气,为进行有关氯气的性质实验,需要4瓶容积为100ml的氯气(标准状况)。
(1)写出实验室制取氯气的化学反应方程式并标出电子转移的方向及数目。
(2)制取4瓶氯气,理论上需要MnO2固体的质量是多少?(浓盐酸过量,并可以补充)
(3)实际称量的MnO2固体的质量必需多于理论量,主要原因是什么?
【答案】
(共12分)
(1)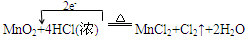 (方程2分,方向数目2分)
(方程2分,方向数目2分)
(2)n(Cl2)= =
= mol(或0.018mol)
mol(或0.018mol)
m(MnO2)=  mol×87g/mol=1.55g(或1.6g)(4分)
mol×87g/mol=1.55g(或1.6g)(4分)
(3)所产生的氯气不可能完全被收集、利用。(4分)
【解析】
试题分析:(2)所需氯气总量为400ml,即0.4L,设所需量为m
MnO2 +4HCl = MnCl2 +Cl2 ↑ +2H2O
87g 22.4L
m 0.4L
即:87*0.4L=22.4L*m 解得:m=1.55g。
(3)随着反应的进行,HCl的浓度逐渐降低,反应无法继续。另外因为在收集气体时要浪费部分气体去排除集气瓶内的气体,所以实际所需的气体量是大于400毫升的,那么所需的反应物固体自然就要大于理论值了。
考点:化学计算
点评:本题重点考查的是关于氯气的相关计算,发生的反应源自于课本,考查学生的计算能力和对课本知识的掌握程度。

练习册系列答案
相关题目