网址:http://m.1010jiajiao.com/timu3_id_76358[举报]
(15分)(1)、美国化学家富兰克林提出了酸碱的溶剂理论,对酸碱定义如下:在某溶剂的溶液中,凡能解离产生该溶剂阳离子的物质为酸;凡能解离产生该溶剂阴离子的物质为碱。这一理论不仅概括了水溶液中的酸碱概念,而且把酸碱概念引入非水溶剂,例如在液氨中2 NH3![]() NH4++NH2-铵盐(如 NH4Cl )表现为酸,氨基化物(如NaNH2)表现为碱。常见的无机非水溶剂有液态氨、硫酸、液态氟化氢、液态二氧化硫、三氟化溴等。已知液体SO2和纯水的导电性相近,实验测得两者的比导电值分别为 8×10-8Ω-1?cm-1和8×10-8Ω-1?cm-1。试用简要的文字和化学反应方程式给出解释:为什么在SO2的液体中,可用Cs2SO3去滴定SOCl2?
NH4++NH2-铵盐(如 NH4Cl )表现为酸,氨基化物(如NaNH2)表现为碱。常见的无机非水溶剂有液态氨、硫酸、液态氟化氢、液态二氧化硫、三氟化溴等。已知液体SO2和纯水的导电性相近,实验测得两者的比导电值分别为 8×10-8Ω-1?cm-1和8×10-8Ω-1?cm-1。试用简要的文字和化学反应方程式给出解释:为什么在SO2的液体中,可用Cs2SO3去滴定SOCl2?
(2)①已知盐酸是强酸,氢氟酸是弱酸。在室温下0.20mol/L氢氟酸水溶液中,氟离子的浓度是0.011mol/L,则氢氟酸的电离常数为 ; 取1.0L 0.20mol/L氢氟酸水溶液与1.0L 0.20mol/L盐酸混合,则溶液中氢离子、氟离子和氢氟酸的浓度各为 、 、 。
②某温度下,K(CH3COOH)=1.0×10-5,若醋酸的起始浓度为0.l0mol/L ,则平衡时溶液的pH是多少?(写出计算过程)
(3)①已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c (Br-)/c (Cl-) = 。②常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3g和2.1×10-1g,往CaSO4悬浊液中通入CO2可得到CaCO3,请解析CaSO4向CaCO3转化的原因。
查看习题详情和答案>>
①若HA为HCN,该溶液显碱性,则溶液中c(CN-)
②若HA为CH3COOH,该溶液显酸性.溶液中所有的离子按浓度由大到小排列的顺序是
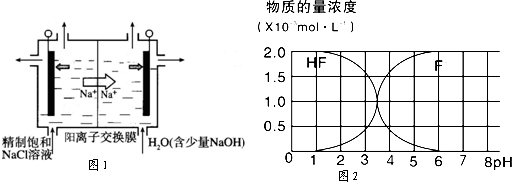
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂,目前已开发出用电解法制取ClO2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:
②电解一段时间,当阴极产生的气体体积为336mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为
(3)25℃时,2.0×10-3mol?L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F-)与溶液pH的变化关系如图2.若将4.0×10-4mol?L-1CaCl2溶液与4.0×10-3mol?L-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出.[已知Ksp(CaF2):1.5×10-10]