摘要:强酸与强碱的稀溶液发生中和反应的热效应: H+(aq)+OH-(aq)====H2O(l),ΔH=-57.3 kJ·mol-1.向1 L 0.5 mol·L-1的NaOH溶液中加入稀醋酸.浓H2SO4.稀HNO3.则恰好完全反应时的热效应ΔH1.ΔH2.ΔH3的关系正确的是( ) A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH3<ΔH2 C.ΔH2>ΔH1>ΔH3 D.ΔH1>ΔH3>ΔH2 解析:强酸的H+与强碱的OH-在稀溶液中发生中和反应的热效应:H+(aq)+OH-(aq)====H2O(l),ΔH=-57.3 kJ·mol-1.由于稀醋酸中主要是醋酸分子.当醋酸和NaOH发生中和反应时.醋酸的电离平衡向电离的方向移动.电离过程要吸热.因此中和反应放出的热量小于57.3 kJ·mol-1.ΔH1>-57.3 kJ·mol-1,而H2SO4稀释时要放出热量.所以ΔH2<-57.3 kJ·mol-1,故D符合题意. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_76220[举报]
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时热效应分别为△H1、△H2、△H3,它们的关系正确的是( )
查看习题详情和答案>>
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.分别向1L 0.5mol?L-1的NaOH溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应的焓变分别为△H1、△H2、△H3,下列关系正确的是( )
查看习题详情和答案>>
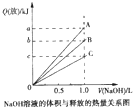 强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.醋酸、浓硫酸、稀硝酸分别与0.1mol?L-1NaOH溶液恰好完全反应放出的热量与消耗NaOH溶液的体积的关系如图所示.则下列描述正确的是( )
强酸与强碱的稀溶液发生中和反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.醋酸、浓硫酸、稀硝酸分别与0.1mol?L-1NaOH溶液恰好完全反应放出的热量与消耗NaOH溶液的体积的关系如图所示.则下列描述正确的是( )
查看习题详情和答案>>