摘要:某温度下将Cl2通入KOH溶液里.反应后得到KCl.KClO.KClO3的混合溶液.经测定ClO-和的物质的量浓度之比为11∶1,则Cl2与KOH反应时.被还原的氯元素和被氧化的氯元素的物质的量之比为( ) A.1∶3 B.4∶3 C.2∶1 D.3∶1 解析:做此题时.不要立即动手写化学方程式并配平.应依据电子守恒关系求解.从反应事实可知.Cl2发生歧化反应.既作氧化剂又作还原剂.KClO与KClO3同为氧化产物.KCl为还原产物.每生成1 mol KClO时.Cl2会失去1 mol e-.每生成1 mol KClO3时.Cl2失去5 mol e-,而每生成1 mol KCl时.Cl2则得到1 mol e-.由电子得失守恒关系.有1×n+5×n(KClO3)=1×n(KCl).又因为n(ClO-)∶n()=11∶1.设n(ClO-)=11 mol.n()=1 mol.则不难求出n(Cl-)=16 mol.所以被还原的Cl元素与被氧化的Cl元素物质的量之比为16∶=4∶3. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_75737[举报]
某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
查看习题详情和答案>>
某温度下将Cl2通入KOH溶液里,反应后得KCl、KClO、KClO3的混合溶液,经测定ClO-和ClO-3两离子的物质的量浓度之比为1∶2,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.2∶3 B.4∶3 C.10∶3 D.11∶3
查看习题详情和答案>>
某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-和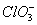 的物质的量浓度之比为11∶1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
的物质的量浓度之比为11∶1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
( )
A.1∶3 B.4∶3 C.2∶1 D.3∶1
查看习题详情和答案>>