网址:http://m.1010jiajiao.com/timu3_id_75593[举报]
下表为元素周期表短周期的一部分
| | | | | |
| A | B | D | | |
| H | | | | |
(2)写出工业上制备H单质的化学方程式 ;
(3)X、Y为同周期元素,它们简单离子的电子层结构与D离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式 。
(4)与Y同周期的W元素,其原子半径是同周期主族元素中最小的。工业上制取Y和W的无水化合物方法如下:Y的氧化物与A、W的单质在高温条件下反应,每消耗6 kg A的单质,过程中转移
1×103 mol电子,写出相应反应的化学方程式 。
(5)X与B形成的化合物XB3是合成抗禽流感药物“达菲”的中间活性物质,该物质受撞击会生成一种非金属单质和一种离子化合物X3B,请写出该反应的化学方程式 查看习题详情和答案>>
| | | | | |
| A | B | D | | |
| H | | | | |
(2)写出工业上制备H单质的化学方程式 ;
(3)X、Y为同周期元素,它们简单离子的电子层结构与D离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式 。
(4)与Y同周期的W元素,其原子半径是同周期主族元素中最小的。工业上制取Y和W的无水化合物方法如下:Y的氧化物与A、W的单质在高温条件下反应,每消耗6 kg A的单质,过程中转移
1×103 mol电子,写出相应反应的化学方程式 。
(5)X与B形成的化合物XB3是合成抗禽流感药物“达菲”的中间活性物质,该物质受撞击会生成一种非金属单质和一种离子化合物X3B,请写出该反应的化学方程式
图2-4
A. 2-S(aOb) B. 1-S(aOb) C. 2-S(abd) D. 1-S(dOb)
查看习题详情和答案>>(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH 0,△S 0 (填“<,>或=”)。
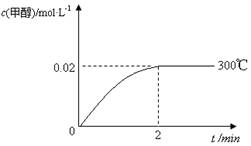
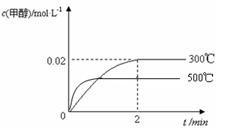
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
①在0~2min内,以H2表示的平均反应速率为 mol·L-1·s-1。
②列式计算300℃时该反应的平衡常数K = 。
③300℃时,将0.50mol CO、1.00mol H2和1.00 molCH3OH充入容积为2L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
【解析】(1)根据反应的特点可知△S小于0,因为反应在300℃,5MPa条件下能自发进行,所以根据△G=△H-T·△S可知反应是放热反应。
(2)①反应速率通常用单位时间内浓度的变化量来表示,根据图像可知反应进行到2min时甲醇
的浓度不再发生变化,平衡时甲醇的物质的量是0.04mol,则消耗氢气是0.08mol,所以在0~2min
内,以H2表示的平均反应速率为![]() 。
。
②平衡时氢气的浓度是![]() ,CO的平衡浓度是
,CO的平衡浓度是
![]() ,所以该温度下的平衡常数为
,所以该温度下的平衡常数为![]() 。
。
③300℃时,将0.50mol CO、1.00mol H2和1.00 molCH3OH充入容积为2L的密闭容器中,此时它们的浓度分别为0.25mol/L、0.50mol/L、、0.50mol/L,因为![]() >4,所以反应向逆反应方向移动。
>4,所以反应向逆反应方向移动。
④压缩体积,压强增大,平衡向正反应方向移动。选项B是降低生成物浓度,平衡也向正反应方
向移动。充入He,使体系总压强增大,但物质但浓度没有变化,所以平衡不移动。再充入0.20mol
CO和0.58mol H2,相当于增大体系的压强,平衡向正反应方向移动,所以答案是ABD。
(3)因为反应是放热反应,所以升高温度平衡向逆反应方向移动,但反应速率会加快,所以图
像为
查看习题详情和答案>>
(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH 0,△S 0 (填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
①在0~2min内,以H2表示的平均反应速率为 mol·L-1·s-1 。
②列式计算300℃时该反应的平衡常数K = 。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
【解析】(1)根据反应的特点可知△S小于0,因为反应在300℃,5MPa条件下能自发进行,所以根据△G=△H-T·△S可知反应是放热反应。
(2)①反应速率通常用单位时间内浓度的变化量来表示,根据图像可知反应进行到2min时甲醇
的浓度不再发生变化,平衡时甲醇的物质的量是0.04mol,则消耗氢气是0.08mol,所以在0~2min
内,以H2表示的平均反应速率为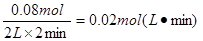 。
。
②平衡时氢气的浓度是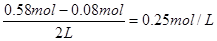 ,CO的平衡浓度是
,CO的平衡浓度是
 ,所以该温度下的平衡常数为
,所以该温度下的平衡常数为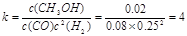 。
。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol
CH3OH充入容积为2L的密闭容器中,此时它们的浓度分别为0.25mol/L、0.50mol/L、、0.50mol/L,因为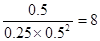 >4,所以反应向逆反应方向移动。
>4,所以反应向逆反应方向移动。
④压缩体积,压强增大,平衡向正反应方向移动。选项B是降低生成物浓度,平衡也向正反应方
向移动。充入He,使体系总压强增大,但物质但浓度没有变化,所以平衡不移动。再充入0.20mol
CO和0.58mol H2,相当于增大体系的压强,平衡向正反应方向移动,所以答案是ABD。
(3)因为反应是放热反应,所以升高温度平衡向逆反应方向移动,但反应速率会加快,所以图
像为
查看习题详情和答案>>