网址:http://m.1010jiajiao.com/timu3_id_75440[举报]
下列说法正确的是( )
A.使元素的化合态转化成游离态的过程就是还原的过程
B.高炉炼铁的原料有铁矿石、焦炭和空气。工业上就是用焦炭还原铁矿石以制得生铁
C.电解熔融氧化铝时,每还原出1 kg铝,必有111 mol电子转移
D.工业上常用电解NaCl水溶液的方法制取金属钠
查看习题详情和答案>>下列说法正确的是( )
| A.有些活泼金属如铝可用作热还原法的还原剂 |
| B.用电解NaCl溶液的方法来冶炼金属钠 |
| C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
| D.使元素由化合态转化成游离态的过程就是还原的过程 |
| A.有些活泼金属如铝可用作热还原法的还原剂 |
| B.用电解NaCl溶液的方法来冶炼金属钠 |
| C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
| D.使元素由化合态转化成游离态的过程就是还原的过程 |
(Ⅰ)多项选择题
下列说法中正确的是________.
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用 sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(Ⅱ)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________.
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是________,其中Ti4+的氧配位数为________,Ba2+的氧配位数为________.
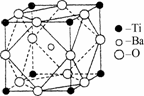
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是________晶体.
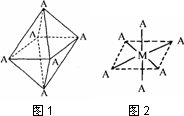
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子).配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有________种同分异构体.
(Ⅲ)(1)已知过氧化氢分子的空间结构如下图所示,分子中氧原子采取________杂化.(2)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化关系:

R3+![]() R(OH)3
R(OH)3![]() [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为________;
②[R(OH)4]-中存在的化学键是________.
A.离子键
B.极性键
C.非极性键
D.配位键
汽车为推动人类文明、生活方便舒适起着重要作用,但同时也恶化了自然生态环境。汽车每年排放的一氧化碳、碳氢化合物、一氧化氮等有害气体占大气污染总量的60%以上。
(1)一氧化氮与一氧化碳都是汽车尾气中的有害气体,它们在催化转换器中能反应氮气和二氧化碳,对此反应,下列说法中正确的是( )
A.使用催化剂不能加大反应速率 B.升高温度能加大反应速率
C.改变压强对反应速率没有影响 D.降低压强能加大反应速率
(2)假设辛烷气对空气的体积之比(在相同条件下)为a,要使辛烷完全燃烧,amax是 。
(3)①若辛烷气对空气的体积之比大于amax,2mol辛烷燃烧生成的有害气体的含量为xmol时,其反应的化学方程式为 。
②当辛烷气对空气体积之比小于amax时,则尾气所污染大气的有害气体增多的是 ,产生此气体的化为方程式为 。
II、食盐中含有碘酸钾。
已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32―=2I-+S4O62-。
(1)若检验食盐中所含碘酸钾,可利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验生成的碘时,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量:
a.称取a g食盐并加蒸馏水使其完全溶解;
b.将所得溶液用稀硫酸酸化,再加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,用1.0×10-3mol/L Na2S2O3溶液进行滴定,当消耗20.0mLNa2S2O3溶液时达到滴定终点。则加碘食盐样品中的碘元素含量是 mg/kg(以含a的代数式表示)。
(3)若向食盐溶液中加入淀粉溶液和KI溶液,振荡。溶液无变化。然后再滴入1滴稀H2SO4,振荡,溶液变蓝色
①用离子方程式表示实验中产生蓝色现象的可能原因 。
②根据此实验结果,请对(2)的实验结果作出简要评价: 。(填“偏大”或“偏小”)
查看习题详情和答案>>