摘要:6.下列叙述正确的是( ) A.c(NH)相等的(NH4)2SO4溶液.(NH4)2Fe(SO4)2溶液和NH4Cl溶液中.溶质浓度大小关系是: c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) B.向AgCl悬浊液中滴入KI溶液.有AgI沉淀生成.说明AgCl的溶解度小于AgI的溶解度 C.0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2 溶液混合后.溶液的pH=1 D.0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO)+c(OH-) 解析:A项中首先忽略水解和弱电解质的电离.则确定NH4Cl浓度最大.在此条件下NH浓度相同的另外两种溶液中.(NH4)2Fe(SO4)2中的Fe2+水解显酸性.抑制了NH的水解.所以其浓度最小,B项中的现象说明AgI的溶解度更小,C项中的pH=-1g=-1g 0.05 .所以错误,在NaHCO3溶液中HCO既水解:HCO+H2OH2CO3+OH-.又电离HCOH++CO.溶液显碱性.所以满足c(OH-)+c(CO)=c(H2CO3)+c(H+).D项错误. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_75399[举报]
图是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:
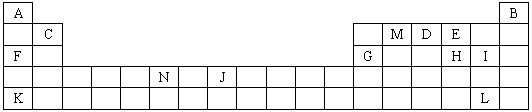
(1)上述所列元素的原子中,最外层电子层上只有两个电子的是
(2)下列叙述正确的是
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
f.电负性由大到小的顺序:E>D>M
g.第一电离能由大到小的顺序:E>D>M
(3)预测DA4+离子的空间构型为
(4)向含有CoCl3?5NH3的溶液中加入硝酸银溶液,可析出AgCl沉淀.经测定,每1mol CoCl3?5NH3只生成2molAgCl.
请写出表示此配合物结构的化学式(钴的配位数为6):
查看习题详情和答案>>

(1)上述所列元素的原子中,最外层电子层上只有两个电子的是
He、Be、Fe
He、Be、Fe
;(填“元素符号”)(2)下列叙述正确的是
a、c、d、f
a、c、d、f
;(填字母序号)a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
f.电负性由大到小的顺序:E>D>M
g.第一电离能由大到小的顺序:E>D>M
(3)预测DA4+离子的空间构型为
正四面体型
正四面体型
,ME2的空间构型为直线型
直线型
;(4)向含有CoCl3?5NH3的溶液中加入硝酸银溶液,可析出AgCl沉淀.经测定,每1mol CoCl3?5NH3只生成2molAgCl.
请写出表示此配合物结构的化学式(钴的配位数为6):
Co(NH3)5Cl]Cl2
Co(NH3)5Cl]Cl2
,此配合物中Co的化合价为+3
+3
.水的电离过程为H2O H+ + OH-,在不同温度下其离子积为:Kw(25℃)=1×10-14, Kw(35℃)=2.1 ×10-14。则下列叙述正确的是
H+ + OH-,在不同温度下其离子积为:Kw(25℃)=1×10-14, Kw(35℃)=2.1 ×10-14。则下列叙述正确的是
| A.c(H+)随着温度的升高而降低 | B.在35℃时,纯水中 c(H+) >c(OH-) |
| C.水的电离常数K(25℃)>K(35℃) | D.水的电离是一个吸热过程 |
水的电离过程为H2O H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14, KW(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其离子积为KW(25℃)=1.0×10-14, KW(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随温度的升高而降低 B.35℃时,c(H+)>c(OH-)
C.溶液:pH(35℃)>pH(25℃) D.水的电离是吸热的过程
查看习题详情和答案>>