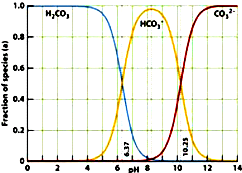
摘要:5.如图是一水溶液在pH从0至14的范围内.H2CO3.HCO.CO三种成分平衡时的组成百分率.下列叙述正确的是( ) A.此图可完全根据1.0 mol/L HCl溶液滴定1.0 mol/L碳酸钠溶液的实验数据绘出 B.1.0 mol/L HCl溶液滴定1.0 mol/L碳酸钠溶液恰好反应时.溶液呈中性 C二氧化碳溶液在血液中多以HCO的形式存在. D.在pH为6.37及10.25时.溶液中c(H2CO3)=c(HCO)=c(CO) 解析:1.0 mol/L HCl溶液滴定1.0 mol/L Na2CO3溶液时.溶液中的pH呈下降趋势.当CO转变为HCO后.继续滴加HCl溶液.会生成CO2.而不是H2CO3.H2CO3在酸性溶液中不存在.所以A错误,当溶液为中性时.应是碳酸与HCO共存的情况.因此B项错误,由图像可判断.pH=8时.主要以HCO的形式存在.则C项正确,根据图像可知.碳酸与碳酸根离子不能同时存在.D项错误. 答案:C
网址:http://m.1010jiajiao.com/timu3_id_75398[举报]
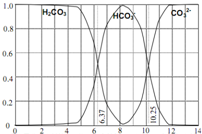 如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是( )
如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是( )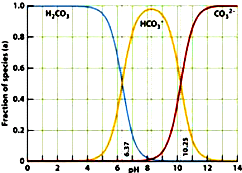 (2009?黄浦区二模)如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的各组分分数,下列叙述正确的是( )
(2009?黄浦区二模)如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的各组分分数,下列叙述正确的是( )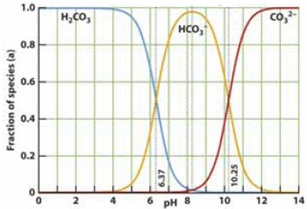 如图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是
如图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是