题目内容
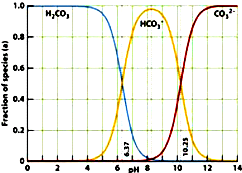
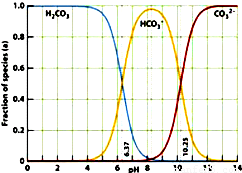
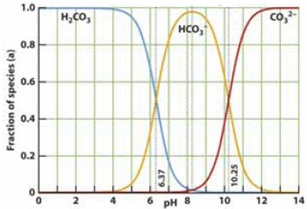 如图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是
如图是一水溶液在pH从 0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是( )
分析:A.由图象可以看出,开始H2CO3浓度最大,CO32-浓度最小,不可能根据1.0 mol?L-1HCl溶液滴定1.0 mol?L-1碳酸钠溶液的实验数据绘出;
B.H2CO3可大量存在与酸性环境中,CO32-存在与碱性环境中;
C.等体积的1.0 mol?L-1HCl溶液和1.0 mol?L-1碳酸钠溶液混合可生成NaHCO3,pH约为8;
D.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-).
B.H2CO3可大量存在与酸性环境中,CO32-存在与碱性环境中;
C.等体积的1.0 mol?L-1HCl溶液和1.0 mol?L-1碳酸钠溶液混合可生成NaHCO3,pH约为8;
D.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-).
解答:解:A.由图象可以看出,开始H2CO3浓度最大,CO32-浓度最小,图象为在碳酸中逐滴滴加氢氧化钠溶液的图象,故A错误;
B.H2CO3可大量存在与酸性环境中,CO32-存在与碱性环境中,不可能大量共存,在pH约为8时,二者可共存,但浓度很小,故B错误;
C.将等体积的1.0 mol?L-1HCl溶液滴加到1.0 mol?L-1碳酸钠溶液可生成NaHCO3,由图象可以看出pH约为8,为碱性溶液,故C错误;
D.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),故D正确.
故选D.
B.H2CO3可大量存在与酸性环境中,CO32-存在与碱性环境中,不可能大量共存,在pH约为8时,二者可共存,但浓度很小,故B错误;
C.将等体积的1.0 mol?L-1HCl溶液滴加到1.0 mol?L-1碳酸钠溶液可生成NaHCO3,由图象可以看出pH约为8,为碱性溶液,故C错误;
D.由图可知,pH为6.37时c(H2CO3)=c(HCO3-),pH为10.25时,c(HCO3-)=c(CO32-),故D正确.
故选D.
点评:本题弱电解质的电离,侧重于考查学生的识图和应用的能力,明确图象中pH与离子的浓度关系是解答本题的关键,难度不大.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
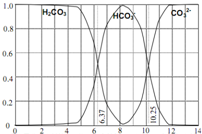 如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是( )
如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的组成百分率,下列叙述正确的是( )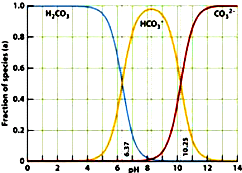 (2009?黄浦区二模)如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的各组分分数,下列叙述正确的是( )
(2009?黄浦区二模)如图是一水溶液在pH从0至14的范围内,H2CO3、HCO3-、CO32-三种成分平衡时的各组分分数,下列叙述正确的是( )