网址:http://m.1010jiajiao.com/timu3_id_75355[举报]
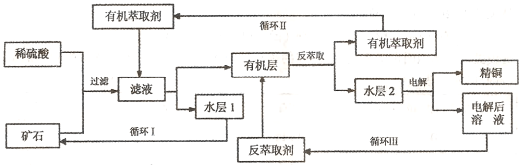
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液.回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等.某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个
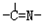 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=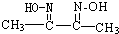
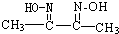
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式
(5)该工艺最大亮点是它符合下列原理
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒 E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称.由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚.某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:
①铁片置于硫酸铜溶液中有铜析出;
②铁、铜和氯气反应分别生成FeCl3和CuCl2;
③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;
④铜片置于FeCl3溶液中铜片逐渐溶解;
⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;
⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生.
以上设计合理的有
A.两种方案 B.三种方案 C.四种方案 D.五种方案.
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol?L-1 KI溶液,滴加0.1mol?L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mL CCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
已知:v(正)=k?cm(I-)?cn(Fe3+)(k为常数)
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
(3)该反应的平衡常数表达式为
(4)已知改变I-、Fe3+的浓度,正反应速率对应数值如下表所示:
| c(I-)/mol?L-1 | c(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
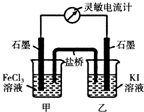
(5)现将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池
①能说明反应达到平衡的标志是
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时
(1)我国南方某些地区的井水取出久置之后,井水由澄清变成少量红棕色絮状沉淀积于缸底,水面浮着一层“锈皮”.这层“锈皮”的主要成分是(写化学式)
(2)家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A.4Fe(OH)2+2H2O+O2═4Fe(OH)3 B.2Fe+2H2O+O2═2Fe(OH)2
C.2H2O+O2+4e-═4OH- D.Fe-3e-═Fe3+
(3)某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O═2Fe(OH)3(胶体)+3H2SO3.为了证明是哪一种反应,同学们设计并实施了下列实验,请填写下列空白:
①实验Ⅰ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液的颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色.这种红褐色液体是
②实验Ⅱ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ,产生的现象完全相同.由上述实验得出的结论是
③若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是
④从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
Ⅰ.
Ⅱ.
(4)自然界中铁矿石主要有赤铁矿和磁铁矿,应用高炉能冶炼制得金属铁.Fe3O4在高炉中有下列反应:Fe3O4+CO═3FeO+CO2
反应形成的固体混合物(FeO、Fe3O4)中,元素氧和铁的质量比用m(O):m(Fe)表示.设Fe3O4被CO还原的质量分数为x,则x与混合物中m(O):m(Fe)的关系式(用含m(O)、m(Fe)的代数式表示):x=
实验Ⅰ,学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是___________________________。
实验Ⅱ,取5 mL FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是_______________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是_______________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为_______________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是___________________________________。
实验Ⅲ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ、Ⅲ,产生的现象完全相同。
由上述实验得出的结论是________________________________________________________。
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是______________________________。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
(1)_______________________________________________________________;
(2)_______________________________________________________________。
查看习题详情和答案>>某化学研究性学习小组讨论Fe3+和SO32—之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32—+H2O=2Fe2++SO42—+2H+;
二是发生双水解反应:2Fe3++3SO32—+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
【实验Ⅰ】学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是 。
【实验Ⅱ】取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 ;向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是. ;
将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成。产生血红色现象的离子方程式是 。
【实验Ⅲ】换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 ;
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是. 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② 。