题目内容
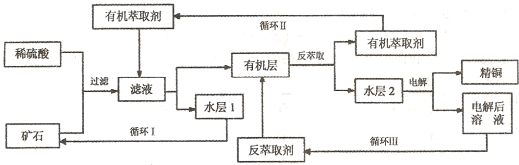
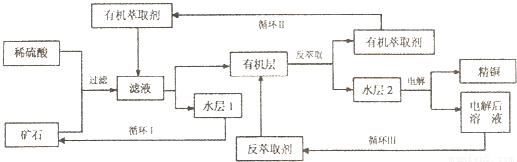
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液.回答下列问题:
(1)矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体.若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式
(3)“循环n”中萃取剂是一类称作为肟类的有机化合物,如N一510、N一530等.某肟类化合物A的分子结构中仅含n1个-CH3、n2个-OH和n3个
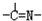 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=

(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式
(5)该工艺最大亮点是它符合下列原理
A.化学平衡 B.绿色化学 C.质量守恒 D.能量守恒 E.相似相溶 F.酸碱中和 G.氧化还原反应
(6)铜、银、金是人类认识最早的三种金属,因为很早就被人们用作钱币,因而有“货币金属”之称.由于铁的金属性比铜、银、金强,相对而言,人类认识铁稍晚.某研究性学习小组为了证明铁的金属活动性比铜强,他设计了如下方案:
①铁片置于硫酸铜溶液中有铜析出;
②铁、铜和氯气反应分别生成FeCl3和CuCl2;
③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4;
④铜片置于FeCl3溶液中铜片逐渐溶解;
⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生;
⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生.
以上设计合理的有
A.两种方案 B.三种方案 C.四种方案 D.五种方案.
(2)一定条件下,硫酸亚铁经常以FeSO4?7H2O的形式存在,亚铁离子易被氧化为三价铁离子;
(3)根据各个基团的结构特点求算出n3,根据A的相对分子质量写出A的最简式;
(4)电解硫酸铜时,阳极上是氢氧根离子发生失电子的氧化反应;
(5)该工艺过程无污染物生成;
(6)根据金属活动性强弱比较的判断方法分析.
故答案为:CuO+2H+═Cu2++H2O、Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的晶体FeSO4?7H2O,暴露在空气中一段时间后,可被氧气氧化,4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O;
(3)-CH3和一OH都会连到n3,故满足的关系是:n3=n1+n2-2; 由于A的相对分子质量为116,故A的结构简式是CH3-C(=N-OH)-C(=N-OH)-CH3;
故答案为:n1+n2-2;CH3-C(=N-OH)-C(=N-OH)-CH3;
(4)电解硫酸铜时,阳极上是氢氧根离子发生失电子的氧化反应,即4OH--4e-═O2+2H2O,故答案为:4OH--4e-═O2+2H2O;
(5)该工艺过程无污染物生成,符合绿色化学原理,故B正确,故答案为:B;
(6)①活泼性强的置换活泼性弱的,故①正确;
②铁、铜和氯气反应分别生成FeCl3和CuCl2,不能比较铁、铜的活泼性,故②错误;
③足量的铁粉和铜粉和浓硫酸反应生成FeSO4和CuSO4,不能比较铁、铜的活泼性,故③错误;
④铜片置于FeCl3溶液中铜片逐渐溶解,说明三价铁离子氧化性大于二价铜离子,不能比较铁、铜的活泼性,故④错误;
⑤把铁片和铜片置于盛有稀硫酸的烧杯中,交用导线连接,铁片上无气泡产生,而铜片上有气泡产生,在原电池中铁作负极,所以铁的活泼性大于铜,故⑤正确;
⑥把铁片和铜片置于盛有浓硝酸的烧杯中,并用导线连接,铁片上有气泡产生,而铜片上无气泡产生,铁在浓硝酸中会钝化,不能比较铁、铜的活泼性,故⑥错误;
所以设计合理的方案有两种;故A正确;
故答案为:A.

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
 |
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混
合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1) 矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O、
、 (任写其中2个)。
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体
的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写
出水层1暴露在空气中发生反应的离子方程式 。
![]() (3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
(3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
子结构中仅含n1个 —CH3、n2个 —OH 和n3个 三种基团,无环状结构,三种基团的数
目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,
则A的结构简式是 。
(4) 写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(5)“循环Ⅲ”中反萃取剂的主要成分是 。

 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=
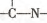 三种基团,无环状结构,三种基团的数目关系为n3=______.若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是______
三种基团,无环状结构,三种基团的数目关系为n3=______.若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是______