摘要:6.固体NH4I放入一个体积为V L的真空密闭容器中.加热至一定温度后.恒温下发生下列反应:NH4I(s) NH3 H2(g)+I2(g).平衡时.测得容器中气体共为5 mol.其中HI为1.5 mol.则下列说法正确的是 ( ) A.平衡时氨气为2.5 mol B.平衡时HI的分解率为20% C.若开始时放入固体NH4I的量增大一倍.则平衡时气体共为10 mol D.其他条件不变把容器的体积缩小到 L.重新达到平衡时H2的浓度是原平衡的2倍 解析:设达平衡时.容器中NH3为a mol.则NH4I分解生成HI也为a mol.平衡时剩余HI为1.5 mol.故在反应 2HI(g)H2(g)+I2mol.同时生成H2和I2的物质的量之和为mol.因此有关系式a+1.5+=5.a=2.5 mol.A项正确,平衡时HI的分解率为 ×100%=40%.B项错误,因为NH4I为固态.改变其用量平衡不移动.C项错误,当其他条件不变.减小容器体积到.因平衡NH4I(s) NH3也向逆反应方向移动导致平衡2HI(g) H2(g)+I2(g)也向逆向移动.使新平衡中H2浓度小于原平衡的2倍. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_75168[举报]
固体NH4I放入一个体积为V L的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)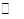 NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g) 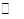 H2(g)+I2(g)。平衡时,测得容器中气体共为5 mol,其中HI为1.5 mol,则下列说法正确的是 ( )
H2(g)+I2(g)。平衡时,测得容器中气体共为5 mol,其中HI为1.5 mol,则下列说法正确的是 ( )
A.平衡时氨气为2.5 mol
B.平衡时HI的分解率为20%
C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol
D.其他条件不变,把容器的体积缩小到L,重新达平衡时H2的浓度是原平衡的2倍
查看习题详情和答案>>
固体NH4I放入一个体积为VL的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s) NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g) H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是(
)
H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是(
)
A.平衡时氨气为2.5mol
B.平衡时HI的分解率为20%
C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol
D.其他条件不变把容器的体积缩小到V/2 L,重新达到平衡时H2的浓度是原平衡的2倍
查看习题详情和答案>>
固体NH4I放入一个体积为VL的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s) NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g) H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是( )
| A.平衡时氨气为2.5mol |
| B.平衡时HI的分解率为20% |
| C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol |
| D.其他条件不变把容器的体积缩小到V/2 L,重新达到平衡时H2的浓度是原平衡的2倍 |
 NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g)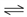 H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是
H2(g)+I2(g)。平衡时,测得容器中气体共为5mol,其中HI为1.5mol,则下列说法正确的是