摘要:6.玻璃棒是中学化学常用仪器.在下列实验中都用到玻璃棒: ①粗盐提纯, ②一定溶质的质量分数溶液的配制, ③一定物质的量浓度的溶液的配制, ④测定某溶液的酸碱性, ⑤用浓盐酸检验氨气, ⑥证明浓硫酸具有脱水性, ⑦测定硫酸铜晶体中的结晶水, ⑧实验室制取乙酸乙酯. 其中作用完全相同的是 ( ) A.①②③ B.④⑤⑥ C.②⑥⑦ D.④⑤⑧ 答案:A
网址:http://m.1010jiajiao.com/timu3_id_74439[举报]
玻璃棒是中学化学常用仪器,在下列实验中,都用到玻璃棒:①粗盐提纯 ②一定溶质的质量分数溶液的配制 ③一定物质的量溶液的溶液配制④用pH试纸测定某溶液的酸碱性 ⑤用浓盐酸检验氨气 ⑥证明浓硫酸具有脱水性 ⑦测定硫酸铜晶体中的结晶水的含量.其中作用完全相同的是( )
| A、①②③ | B、④⑤⑥ | C、②⑥⑦ | D、全部 |
|
玻璃棒是中学化学常用仪器,在下列实验中,都用到玻璃棒: ①粗盐提纯 ②一定溶质的质量分数溶液的配制 ③一定物质的量溶液的溶液配制 ④用pH试纸测定某溶液的酸碱性 ⑤用浓盐酸检验氨气 ⑥证明浓硫酸具有脱水性 ⑦测定硫酸铜晶体中的结晶水的含量.其中作用完全相同的是 | |
| [ ] | |
A. |
①②③ |
B. |
④⑤⑥ |
C. |
②⑥⑦ |
D. |
全部 |
玻璃棒是中学化学常用仪器,在下列实验中都用到玻璃棒:
①粗盐提纯;
②一定溶质的质量分数溶液的配制;
③一定物质的量浓度的溶液的配制;
④测定某溶液的酸碱性;
⑤用浓盐酸检验氨气;
⑥证明浓硫酸具有脱水性;
⑦测定硫酸铜晶体中的结晶水;
⑧实验室制取乙酸乙酯。
其中起到搅拌和引流作用的是 ( )
A.①②③ B.④⑤⑥ C.②⑥⑦ D.④⑤⑧
查看习题详情和答案>>Ⅰ(1)玻璃棒是中学化学实验中常用的仪器.下列过程中,一般不需要玻璃棒的是
①用PH试纸测定Na2CO3溶液的PH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化.
⑤实验室用新制备的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)用“大于”“等于”“小于”填空
①读量筒中液体的体积时,视线偏高,读取的体积数
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称食盐的质量
③配制500ml 0.1mol/lNaOH溶液,定容时俯视刻度线,所得溶液的物质的量浓度
④用中和滴定法测某NaOH溶液的浓度,量取待测液未用该溶液润洗滴定管,测得的溶液的浓度
Ⅱ、氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:
2
+10H++8e-→N2O+5H2O
Fe(SO4)3、KMnO4、Na2CO3、FeSO4四种物质中的一种物质能使上述还原过程发生.
(1)写出该氧化还原反应的方程式(不配平):
(2)该反应中氧化剂和还原剂物质的量之比为
(3)反应中硝酸体现了
(4)反应中若产生0.1mol气体,则转移电子的物质的量是
查看习题详情和答案>>
③⑤
③⑤
( 填写编号 )①用PH试纸测定Na2CO3溶液的PH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化.
⑤实验室用新制备的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)用“大于”“等于”“小于”填空
①读量筒中液体的体积时,视线偏高,读取的体积数
大于
大于
实际体积数②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称食盐的质量
小于
小于
10.4g③配制500ml 0.1mol/lNaOH溶液,定容时俯视刻度线,所得溶液的物质的量浓度
大于
大于
0.1mol/l④用中和滴定法测某NaOH溶液的浓度,量取待测液未用该溶液润洗滴定管,测得的溶液的浓度
小于
小于
实际浓度Ⅱ、氧化还原反应中实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:
2
| NO | - 3 |
Fe(SO4)3、KMnO4、Na2CO3、FeSO4四种物质中的一种物质能使上述还原过程发生.
(1)写出该氧化还原反应的方程式(不配平):
FeSO4+HNO3→N2O+Fe2(SO4)3+Fe(NO3)3+H2O;
FeSO4+HNO3→N2O+Fe2(SO4)3+Fe(NO3)3+H2O;
.(2)该反应中氧化剂和还原剂物质的量之比为
1:4
1:4
.(3)反应中硝酸体现了
氧化性
氧化性
、酸性
酸性
性质.(4)反应中若产生0.1mol气体,则转移电子的物质的量是
0.8mol
0.8mol
.
Ⅰ.玻璃棒是中学化学实验室中常用的仪器.下列实验过程中,一般不需要用玻璃棒的是 (填写编号)
①用pH试纸测定Na2CO3溶液的pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)28H20晶体和NH4Cl晶体反应过程中的能量变化
⑤用蒸馏法分离两种沸点差距较大的液体
⑥过滤分离互不相溶的固体和液体
⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程
⑧稀释浓H2SO4的过程
Ⅱ.为测定某含有杂质Na2O的Na2O2样品的纯度,某小组同学分别设计了如下方案.
[方案一]准确称量样品mg,与水充分反应后将溶液的体积稀释为VmL,从中取出V1mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量.
(1)此方案中,酸碱中和滴定时应选用 滴定管.
(2)写出此方案中涉及到的反应的离子方程式 .
[方案二]准确称量样品mg,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量.
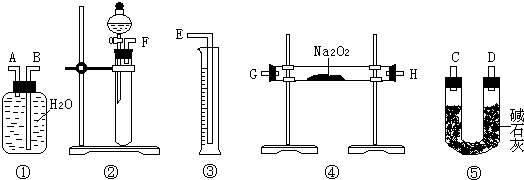
(3)该方案的实验过程中,如图,仪器的连接顺序是 (填仪器下方序号),①中的进气口为 (填“A”或“B”)
(4)装置⑤的作用是 .
(5)你认为方案一、方案二中测定结果比较准确的是 .
查看习题详情和答案>>
①用pH试纸测定Na2CO3溶液的pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)28H20晶体和NH4Cl晶体反应过程中的能量变化
⑤用蒸馏法分离两种沸点差距较大的液体
⑥过滤分离互不相溶的固体和液体
⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程
⑧稀释浓H2SO4的过程
Ⅱ.为测定某含有杂质Na2O的Na2O2样品的纯度,某小组同学分别设计了如下方案.
[方案一]准确称量样品mg,与水充分反应后将溶液的体积稀释为VmL,从中取出V1mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量.
(1)此方案中,酸碱中和滴定时应选用
(2)写出此方案中涉及到的反应的离子方程式
[方案二]准确称量样品mg,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量.

(3)该方案的实验过程中,如图,仪器的连接顺序是
(4)装置⑤的作用是
(5)你认为方案一、方案二中测定结果比较准确的是