摘要:6.侯德榜先生为我国制纯碱工业做出伟大成就.历只上创造国际先进水平.由信息中分析.先生产碳酸氢铵.而在盐析作用下.溶解度小的析出.副产品为. 受热物分解.转化为纯碱.和.循环使用. 答案:
网址:http://m.1010jiajiao.com/timu3_id_7417[举报]
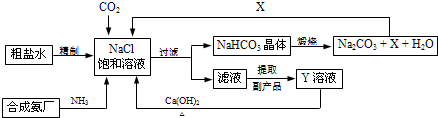
我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献.其生产工艺流程示意图如下:

制碱原理可表示为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(1)X的化学式为
(2)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,Y的化学式为
(3)Y常用作氮肥使植物生长茂盛,叶色浓绿,现有用熟石灰改良过的酸性土壤需要施加氮肥,
查看习题详情和答案>>

制碱原理可表示为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
(1)X的化学式为
CO2
CO2
.(2)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,Y的化学式为
NH4Cl
NH4Cl
,此反应产生的可循环利用的物质的名称为氨气
氨气
.(3)Y常用作氮肥使植物生长茂盛,叶色浓绿,现有用熟石灰改良过的酸性土壤需要施加氮肥,
不可以
不可以
(填“可以”或“不可以”)使用Y.我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献.其生产工艺流程示意图如图: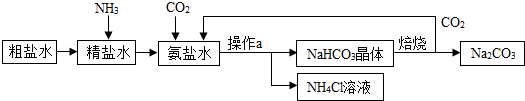
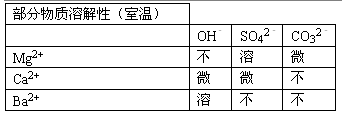
【资料】四种盐在不同温度下的溶解度表
(1)检验粗盐水是否为硬水的方法是加入 ;
(2)操作a是 ,生产流程中被循环利用的物质是 ;
(3)在精盐水中先通入NH3,使溶液呈 性,再通入CO2,有利于对CO2的吸收;
(4)氨盐水中通入二氧化碳后,在常温条件下,易析出NaHCO3晶体而不析出NH4Cl晶体的可能原因是 ;
(5)粗盐水中主要含有CaCl2、MgCl2等杂质,工业上常加入下列物质除杂、精制,则加入下列三种试剂合理的顺序为 (填序号);
A.适量的盐酸 B.稍过量的Na2CO3溶液C.稍过量的Ca(OH)2溶液
(6)副产品NH4Cl可做 肥,若加入氢氧化钠加热,反应的化学方程式为 .
查看习题详情和答案>>

【资料】四种盐在不同温度下的溶解度表
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO3 | 15.8 | 21.0 | 27.0 | -- | -- |
| NaHCO3 | 8.1 | 9.6 | 11.1 | 12.7 | -- |
| NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(2)操作a是
(3)在精盐水中先通入NH3,使溶液呈
(4)氨盐水中通入二氧化碳后,在常温条件下,易析出NaHCO3晶体而不析出NH4Cl晶体的可能原因是
(5)粗盐水中主要含有CaCl2、MgCl2等杂质,工业上常加入下列物质除杂、精制,则加入下列三种试剂合理的顺序为
A.适量的盐酸 B.稍过量的Na2CO3溶液C.稍过量的Ca(OH)2溶液
(6)副产品NH4Cl可做
我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献.其生产工艺流程示意图如图所示:

(1)粗盐水中主要含有 、Mg2+、
、Mg2+、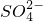 等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、制精.则加入试剂合理的顺序为______、盐酸(只写一种).
等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、制精.则加入试剂合理的顺序为______、盐酸(只写一种).
(2)制碱原理为:NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,该反应原理可看作是由①CO2+NH3+H2O═NH4HCO3和②NaCl+NH4HCO3═NaHCO3↓+NH4Cl两个反应加合而成,则②的反应类型为______.
(3)X的化学式为______.
(4)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为______,写出Y的一种用途______.
部分物质溶解性(室温)
| OH- | 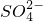 | 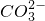 | |
 | 不 | 溶 | 微 |
| Ca2+ | 微 | 微 | 不 |
| Ba2+ | 溶 | 不 | 不 |
我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献.其生产工艺流程示意图如下:
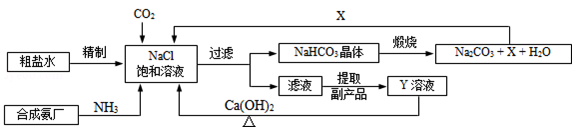
(1)粗盐水中主要含有Ca2+、Mg2+、SO42﹣等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、精制.则加入试剂合理的顺序为________________________、盐酸(只写一种).加盐酸的作用是(用化学方程式表示)_____________________________________、___________________________________.
(2)制碱原理为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,该反应原理可看作是由:①CO2+NH3+H2O=NH4HCO3和 ②NaCl+NH4HCO3=NaHCO3↓+NH4Cl两个反应加合而成,则的反应类型为________________.
(3)X的化学式为___________.
(4)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为________,Y的化学式为__________,写出Y的一种用途_________.
查看习题详情和答案>>
(2)制碱原理为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,该反应原理可看作是由:①CO2+NH3+H2O=NH4HCO3和 ②NaCl+NH4HCO3=NaHCO3↓+NH4Cl两个反应加合而成,则的反应类型为________________.
(3)X的化学式为___________.
(4)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为________,Y的化学式为__________,写出Y的一种用途_________.