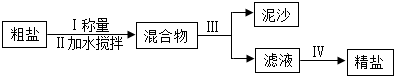
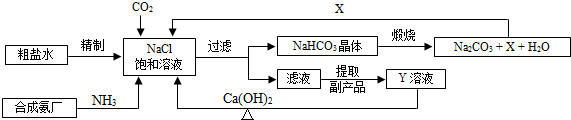
题目内容
我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献.其生产工艺流程示意图如图所示:

(1)粗盐水中主要含有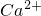 、Mg2+、
、Mg2+、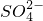 等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、制精.则加入试剂合理的顺序为______、盐酸(只写一种).
等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、制精.则加入试剂合理的顺序为______、盐酸(只写一种).
(2)制碱原理为:NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,该反应原理可看作是由①CO2+NH3+H2O═NH4HCO3和②NaCl+NH4HCO3═NaHCO3↓+NH4Cl两个反应加合而成,则②的反应类型为______.
(3)X的化学式为______.
(4)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为______,写出Y的一种用途______.
部分物质溶解性(室温)
| OH- | 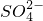 | 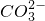 | |
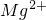 | 不 | 溶 | 微 |
| Ca2+ | 微 | 微 | 不 |
| Ba2+ | 溶 | 不 | 不 |
解:(1)要除去粗盐水中含有的Ca2+、Mg2+、SO42-,首先加入过量的氯化钡溶液除去硫酸根离子,然后加入过量的碳酸钠溶液除去钙离子和多余的钡离子;再加入氢氧化钠溶液除去镁离子,最后加入盐酸除去多余的碳酸根离子和氢氧根离子,故填:BaCl2溶液、Na2CO3溶液、NaOH溶液;
(2)②NaCl+NH4HCO3═NaHCO3↓+NH4Cl,此反应是两种化合物相互交换成分生成了两种新的化合物,是复分解反应,故填:复分解反应;
(3)碳酸氢钠固体受热能分解生成碳酸钠、水和二氧化碳,X为二氧化碳,故填:CO2;
(4)Y溶液的主要成分是氯化铵,氯化铵能与氢氧化钙反应生成氨气,氨气可以循环利用;氯化铵是一种主要的氮肥,故填:氨气,氮肥.
分析:根据已有的知识进行分析,除去粗盐中的杂质时,后加入的除杂试剂必须能把前面多加的试剂除掉,结合反应的化学方程式分析反应的类型;根据反应的化学方程式确定物质的成分,然后说出物质的用途即可.
点评:本题考查了常见物质的制取过程,完成此题,可以依据已有的物质的性质进行.
(2)②NaCl+NH4HCO3═NaHCO3↓+NH4Cl,此反应是两种化合物相互交换成分生成了两种新的化合物,是复分解反应,故填:复分解反应;
(3)碳酸氢钠固体受热能分解生成碳酸钠、水和二氧化碳,X为二氧化碳,故填:CO2;
(4)Y溶液的主要成分是氯化铵,氯化铵能与氢氧化钙反应生成氨气,氨气可以循环利用;氯化铵是一种主要的氮肥,故填:氨气,氮肥.
分析:根据已有的知识进行分析,除去粗盐中的杂质时,后加入的除杂试剂必须能把前面多加的试剂除掉,结合反应的化学方程式分析反应的类型;根据反应的化学方程式确定物质的成分,然后说出物质的用途即可.
点评:本题考查了常见物质的制取过程,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目