摘要:CClx是工业上重要的溶剂.某学习小组设计了如下实验进行制备.他查得的数据有:CClx为无色液体.有时因含有杂质呈微黄色.具有芳香气味.易挥发.熔点-228 ℃.沸点76 ℃~77 ℃,CH2Cl2沸点404 ℃,CHCl3沸点61 ℃~62 ℃.请结合实验装置回答下列问题: (1)a仪器名称是: ,b中反应前加入的试剂是 ,为除去气体中含有的氯化氢.C中应加入的液体是 ,B装置的作用是: . (2)制备CCl4的化学反应原理是 . (3)制备CCl4的过程中量筒中可观察到的现象为 . (4)为得到较纯净的CCl4.应采用的分离方法为 .
网址:http://m.1010jiajiao.com/timu3_id_73437[举报]
 Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 | 4 |
(1)写出相应元素符合,A
H
H
BN
N
CO
O
ES
S
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴入紫色石蕊试液出现红色,则溶液中离子浓度由大到小的排列顺序为:
c(Na+)>c(HSO3-)>c(H+ )>c(SO32-)>c(OH-)
c(Na+)>c(HSO3-)>c(H+ )>c(SO32-)>c(OH-)
.(3)将铝片和镁片.插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为
2Al-6e-+8OH-=2AlO2-+4H2O
2Al-6e-+8OH-=2AlO2-+4H2O
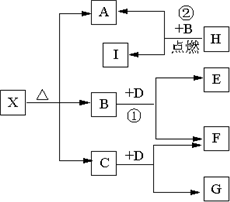
.Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系.
试回答下列问题
(1)G的化学式为:
NaOH
NaOH
.(2)写出下列反应的化学方程式
①
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
②2Mg+CO2  2MgO+C
2MgO+C
 2MgO+C
2MgO+C2Mg+CO2  2MgO+C
2MgO+C
. 2MgO+C
2MgO+C
BrCl沸点为10℃,遇水剧烈水解,有强烈的氧化性,是工业上重要的水处理杀菌剂.Br2沸点为58.8℃.某实验小组在实验室合成BrCl,其装置如图所示(夹持仪器略去):
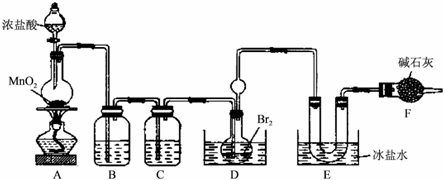
回答下列问题:
(1)装置C中的试剂为 .
(2)装置A中发生反应的离子方程式为 .
(3)装置D中球形容器及长导管的作用是 ,装置D用水浴加热并控制温度40-42℃,温度不宜过高的原因是 .
(4)提纯E中得到的粗BrCl的实验操作方法是 .
查看习题详情和答案>>

回答下列问题:
(1)装置C中的试剂为
(2)装置A中发生反应的离子方程式为
(3)装置D中球形容器及长导管的作用是
(4)提纯E中得到的粗BrCl的实验操作方法是
(2011?上饶二模)下列各物质的相互转变中,反应①、②是工业上重要的反应,A的相对分子质量为120.X被人体吸入会与血红蛋白结合而使人中毒,Y会造成温室效应,D会形成酸雨,E是常见的金属,F分子的结构与Y分子的结构相似,且F的相对分子质量为60.

回答下列问题:
(1)写出下列物质的化学式:A
(2)反应①的化学方程式为
(3)反应②的化学方程式为
(4)写出F的结构式
(5)Y与H2在一定条件下可生成多种物质,既可获得经济效益,也可减轻对环境的污染.
①若G是一种燃料,其相对分子质量与B的相对分子质量相等,则G的结构简式为
②若G是Y与H2按1:3的比例反应而得的烃类有机物,则G可能是
查看习题详情和答案>>

回答下列问题:
(1)写出下列物质的化学式:A
FeS2
FeS2
,EFe
Fe
.(2)反应①的化学方程式为
4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
.
| ||
(3)反应②的化学方程式为
Fe2O3+2CO
2Fe+3CO2
| ||
Fe2O3+2CO
2Fe+3CO2
.
| ||
(4)写出F的结构式
O═C═S
O═C═S
.(5)Y与H2在一定条件下可生成多种物质,既可获得经济效益,也可减轻对环境的污染.
①若G是一种燃料,其相对分子质量与B的相对分子质量相等,则G的结构简式为
CH3OH
CH3OH
.②若G是Y与H2按1:3的比例反应而得的烃类有机物,则G可能是
C2H4
C2H4
.已知X是一种盐,H是一种古代劳动人民就已掌握冶炼技术的金属单质,F、P、J是常见的非金属单质,I、E、G都是工业上重要的碱性物质,P和J在一定条件下反应生成I.它们有如下的关系,试回答下列问题:

(1)G的化学式为
(2)写出下列反应的化学方程式:
①
②
(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,进一步探究X中各元素的质量关系.
 ①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
②向装置中鼓入空气的目的是
③如何判断X已完全分解?
④更精确的测定得出如下数据:X受热后完全分解,固体由16.52g变为12.00g,装置乙增重1.44g.写出X的化学式
请写出X与盐酸反应的化学方程式为:
(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质M,其中M能使硝酸酸化的硝酸银溶液产生白色沉淀,写出L的电子式
 .
.
查看习题详情和答案>>

(1)G的化学式为
NaOH
NaOH
;(2)写出下列反应的化学方程式:
①
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
;②
2NH3+3CuO=N2+3Cu+3H2O
2NH3+3CuO=N2+3Cu+3H2O
;(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,进一步探究X中各元素的质量关系.
 ①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;②向装置中鼓入空气的目的是
将X分解产生的水蒸气送入盛有浓硫酸的洗气瓶中
将X分解产生的水蒸气送入盛有浓硫酸的洗气瓶中
;丙装置中药品的名称为无水硫酸铜
无水硫酸铜
,实验时,该药品未见明显变化,证明X分解产生的水蒸气全部被浓硫酸吸收
X分解产生的水蒸气全部被浓硫酸吸收
;③如何判断X已完全分解?
连续两次加热、鼓气、冷却、称量甲装置的质量,
连续两次加热、鼓气、冷却、称量甲装置的质量,
;质量差不超过0.1g
质量差不超过0.1g
.④更精确的测定得出如下数据:X受热后完全分解,固体由16.52g变为12.00g,装置乙增重1.44g.写出X的化学式
7CuCO3?8Cu(OH)2或Cu15(OH)16(CO3)7或15CuO?7CO2?8H2O
7CuCO3?8Cu(OH)2或Cu15(OH)16(CO3)7或15CuO?7CO2?8H2O
.请写出X与盐酸反应的化学方程式为:
7CuCO3?8Cu(OH)2+30HCl=15CuCl2+7CO2↑+23H2O
7CuCO3?8Cu(OH)2+30HCl=15CuCl2+7CO2↑+23H2O
.(4)L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质M,其中M能使硝酸酸化的硝酸银溶液产生白色沉淀,写出L的电子式

