摘要:93.氢阴离子(H-)能与NH3反应.H- + NH3 = NH2- + H2↑.根据上述反应事实可以得 出的正确的结论是 ( ) A.NH3具有还原性 B.H-是很强的还原剂 .该反应的还原产物是H2 D.该反应属于置换反应
网址:http://m.1010jiajiao.com/timu3_id_73162[举报]
已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有7个电子.
请回答下列问题:
(1)G基态原子的核外电子排布式是
(2)C、D、E的第一电离能由大到小的顺序是:
(3)下列有关上述元素的说法中,不正确的是
a.B单质的熔点在同族单质中最高
b.1mol A 2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含
(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为
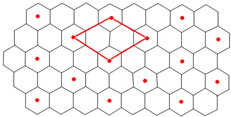
(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“?”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为
查看习题详情和答案>>
请回答下列问题:
(1)G基态原子的核外电子排布式是
1s22s22p63s23p63d74s2
1s22s22p63s23p63d74s2
.(2)C、D、E的第一电离能由大到小的顺序是:
D>E>C
D>E>C
.(3)下列有关上述元素的说法中,不正确的是
bd
bd
.(填字母)a.B单质的熔点在同族单质中最高
b.1mol A 2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含
2
2
个σ键.(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为
[CoCl(NH3)5]Cl2
[CoCl(NH3)5]Cl2
.(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“?”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为
LiC6
LiC6
.
 (2013?青岛一模)[化学-物质结构与性质]
(2013?青岛一模)[化学-物质结构与性质]太阳能电池的发展已经进入了第三代.第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为
[Ar]3d10
[Ar]3d10
;(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为
Br>As>Se
Br>As>Se
(用元素符号表示),用原子结构观点加以解释As、Se、Br原子半径依次减小,原子核对外层电子的吸引力依次增强,元素的第一电离能依次增大;Se原子最外层电子排布为4s24p4,而As原子最外层电子排布为4s24p3,p电子排布处于半充满状态,根据洪特规则特例可知,半充满状态更稳定,所以As元素的第一电离能比Se大
As、Se、Br原子半径依次减小,原子核对外层电子的吸引力依次增强,元素的第一电离能依次增大;Se原子最外层电子排布为4s24p4,而As原子最外层电子排布为4s24p3,p电子排布处于半充满状态,根据洪特规则特例可知,半充满状态更稳定,所以As元素的第一电离能比Se大
;(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成加合物,如BF3能与NH3反应生成BF3?NH3. BF3?NH3中B原子的杂化轨道类型为
sp3
sp3
,B与N之间形成配位
配位
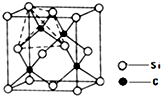
键;(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构;在SiC中,每个C原子周围最近的C原子数目为
12
12
.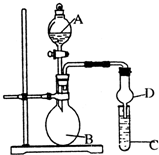 已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:
已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:(1)图中D装置在实验中的作用是
(2)验证氢氧化铝能与强酸反应:若B中的试剂为浓盐酸,C中试剂为Na[Al(OH)4]溶液,则A中的试剂为
(3)验证氢氧化铝不能与弱碱反应:若A中的试剂为浓氨水,则B中试剂为
(4)验证氢氧化铝不能与弱酸反应:C中试剂为
某研究性学习小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验.
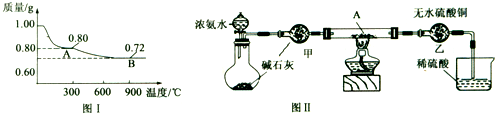
(1)取0.98g Cu(OH)2固体加热,质量随温度变化的曲线如图Ⅰ所示,产物A、B的化学式分别为 和 .
(2)取少量产物B加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,该反应的离子方程式为 .
(3)为证明产物A在加热时能与NH3反应,某同学设计了如图Ⅱ(夹持装置未画出)所示实验装置.
①简述检查该装置气密性的方法 .
②实验过程中观察到两个明显现象:
i直玻璃管中固体由黑色变为红色;
ii装置乙中固体由白色变为蓝色.
能证明产物A与NH3发生了反应的判断依据的是 (填选项字母).
a.只有i可以 b.只有ii可以 c.i或ii都可以.
查看习题详情和答案>>

(1)取0.98g Cu(OH)2固体加热,质量随温度变化的曲线如图Ⅰ所示,产物A、B的化学式分别为
(2)取少量产物B加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,该反应的离子方程式为
(3)为证明产物A在加热时能与NH3反应,某同学设计了如图Ⅱ(夹持装置未画出)所示实验装置.
①简述检查该装置气密性的方法
②实验过程中观察到两个明显现象:
i直玻璃管中固体由黑色变为红色;
ii装置乙中固体由白色变为蓝色.
能证明产物A与NH3发生了反应的判断依据的是
a.只有i可以 b.只有ii可以 c.i或ii都可以.