题目内容
已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有7个电子.
请回答下列问题:
(1)G基态原子的核外电子排布式是
(2)C、D、E的第一电离能由大到小的顺序是:
(3)下列有关上述元素的说法中,不正确的是
a.B单质的熔点在同族单质中最高
b.1mol A 2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含
(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为
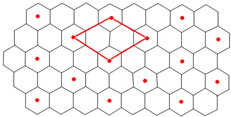
(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“?”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为
请回答下列问题:
(1)G基态原子的核外电子排布式是
1s22s22p63s23p63d74s2
1s22s22p63s23p63d74s2
.(2)C、D、E的第一电离能由大到小的顺序是:
D>E>C
D>E>C
.(3)下列有关上述元素的说法中,不正确的是
bd
bd
.(填字母)a.B单质的熔点在同族单质中最高
b.1mol A 2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含
2
2
个σ键.(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为
[CoCl(NH3)5]Cl2
[CoCl(NH3)5]Cl2
.(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“?”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为
LiC6
LiC6
.
分析:A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,且属于S区,原子序数最小,则A是H元素,B和A同族且位于A的下一周期,则B是Li元素,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则C是C元素;E的基态原子核外成对电子数是未成对电子数的3倍,E是O元素,则D是N元素,F与E不同周期且F在其周期中的电负性最大,则F是Cl元素,G原子d轨道有7个电子,则G是Co元素.
解答:解:A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,且属于S区,原子序数最小,则A是H元素,B和A同族且位于A的下一周期,则B是Li元素,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则C是C元素;E的基态原子核外成对电子数是未成对电子数的3倍,E是O元素,则D是N元素,F与E不同周期且F在其周期中的电负性最大,则F是Cl元素,G原子d轨道有7个电子,则G是Ni元素.
(1)G是钴元素,其核外有27个电子,根据构造原理知,其核外电子排布式为:1s22s22p63s23p63d74s2
,故答案为:1s22s22p63s23p63d74s2;
(2)C是C元素,D是N元素,E是O元素,同一周期元素,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素第一电离能大于第VIA族元素,所以C、N、O的第一电离能大小顺序是:D>E>C,
故答案为:D>E>C;
(3)a.碱金属族元素单质的熔点随着原子序数的增大而减小,所以Li单质的熔点在同族单质中最高,故正确;
b.1molH2O的晶体中含有2mol氢键,故错误;
c.SiO44-与ClO4-互为原子个数和价电子数相等,所以是等电子体,故正确;
d.C3H6直链分子中,甲基上C原子采取sp3杂化,碳碳双键两端的碳原子采用sp2杂化,故错误;
故选b d;
(4)HCN分子的结构简式为:H-C≡N,所以HCN中含有2个σ键,
故答案为:2;
(5)CoCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则一个氯原子位于內界,其配位数是6,则该配合物还含有5个氨气分子位于內界,所以该配合物的化学式为[CoCl(NH3)5]Cl2,
故答案为:[CoCl(NH3)5]Cl2;
(6)C的单质是一种层状结构,Li的离子位于C单质的层间、其投影位于层面内六圆环的中央,Li和C 形成一种化合物,“?”表示B离子的位置,该晶胞中锂离子个数=4×
=1,碳原子个数=2+8×
=6,所以其化学式为:LiC6,
故答案为:LiC6.
(1)G是钴元素,其核外有27个电子,根据构造原理知,其核外电子排布式为:1s22s22p63s23p63d74s2
,故答案为:1s22s22p63s23p63d74s2;
(2)C是C元素,D是N元素,E是O元素,同一周期元素,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素第一电离能大于第VIA族元素,所以C、N、O的第一电离能大小顺序是:D>E>C,
故答案为:D>E>C;
(3)a.碱金属族元素单质的熔点随着原子序数的增大而减小,所以Li单质的熔点在同族单质中最高,故正确;
b.1molH2O的晶体中含有2mol氢键,故错误;
c.SiO44-与ClO4-互为原子个数和价电子数相等,所以是等电子体,故正确;
d.C3H6直链分子中,甲基上C原子采取sp3杂化,碳碳双键两端的碳原子采用sp2杂化,故错误;
故选b d;
(4)HCN分子的结构简式为:H-C≡N,所以HCN中含有2个σ键,
故答案为:2;
(5)CoCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则一个氯原子位于內界,其配位数是6,则该配合物还含有5个氨气分子位于內界,所以该配合物的化学式为[CoCl(NH3)5]Cl2,
故答案为:[CoCl(NH3)5]Cl2;
(6)C的单质是一种层状结构,Li的离子位于C单质的层间、其投影位于层面内六圆环的中央,Li和C 形成一种化合物,“?”表示B离子的位置,该晶胞中锂离子个数=4×
| 1 |
| 4 |
| 1 |
| 2 |
故答案为:LiC6.
点评:本题考查了物质结构及其性质,涉及化学式的确定、配合物、杂化方式、等电子体、第一电离能大小的判断等知识点,这些都是考查热点,注意第一电离能的规律及其异常现象,为易错点,难点是化学式的确定,利用均摊法分析解答,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: