网址:http://m.1010jiajiao.com/timu3_id_72842[举报]
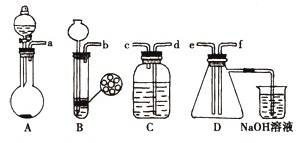 已知实验室制取H2S的实验原理为FeS(块状)+H2SO4═FeSO4+H2S↑.
已知实验室制取H2S的实验原理为FeS(块状)+H2SO4═FeSO4+H2S↑.根据图中A~D的实验装置和试剂进行实验:
(1)装置A是由双孔塞、玻璃导管、
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性.制备SO2的实验原理:
Na2SO3(粉末)+H2SO4(70%)═Na2SO4+SO2↑+H2O.
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是
②C装置中的溶液是
(3)D中产生的现象是
(4)烧杯中发生反应的离子方程式为
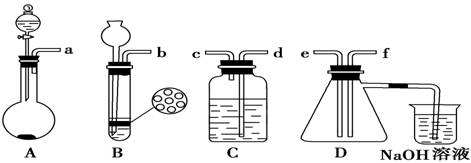
已知实验室制取H2S的实验原理为FeS(块状)+H2SO4===FeSO4+H2S↑。根据下图中A~D 的实验装置和试剂进行实验:
(1)装置A是由双孔塞、玻璃导管、________和________组装起来的。
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性:

制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%)===Na2SO4+SO2↑+H2O。
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是___________。
②C装置中的溶液是 ,说明二氧化硫具有 性。
(3)D中产生的现象是 ,说明二氧化硫具有 性。
(4)烧杯中发生反应的离子方程式为________________________。
查看习题详情和答案>>已知实验室制取H2S的实验原理为FeS(块状)+H2SO4===FeSO4+H2S↑。根据下图中A~D 的实验装置和试剂进行实验:
(1)装置A是由双孔塞、玻璃导管、________和________组装起来的。
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性:
制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%)===Na2SO4+SO2↑+H2O。
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是___________。
②C装置中的溶液是 ,说明二氧化硫具有 性。
(3)D中产生的现象是 ,说明二氧化硫具有 性。
(4)烧杯中发生反应的离子方程式为________________________。
(1)装置A是由双孔塞、玻璃导管、________和________组装起来的。
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性:
制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%)===Na2SO4+SO2↑+H2O。
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是___________。
②C装置中的溶液是 ,说明二氧化硫具有 性。
(3)D中产生的现象是 ,说明二氧化硫具有 性。
(4)烧杯中发生反应的离子方程式为________________________。
已知实验室制取H2S的实验原理为FeS(块状)+H2SO4 FeSO4+H2S↑.根据下图中A~D的实验装置和试剂进行实验:
FeSO4+H2S↑.根据下图中A~D的实验装置和试剂进行实验:

(1)装置A是由双孔塞、玻璃导管、________和________组装起来的.
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性:
制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%) ![]() Na2SO4+SO2↑+H2O.
Na2SO4+SO2↑+H2O.
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是________.
②C装置中的溶液是________,说明二氧化硫具有________性.
(3)D中产生的现象是________,说明二氧化硫具有________性.
(4)烧杯中发生反应的离子方程式为________.