网址:http://m.1010jiajiao.com/timu3_id_72472[举报]
氨在国民经济中占有重要的地位。现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
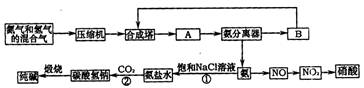
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:

设备A的名称是 ,设备B的名称是 。
(2)硝酸厂的尾气中含有NO和NO2等污染物,为了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:
Na2CO3+2NO2=NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式: 。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用 法和 法进行改进。
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么 。
查看习题详情和答案>>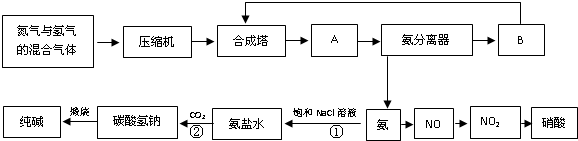
(1)设备A的名称是
(2)有关合成氨工业的说法中,正确的是
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~5×107Pa,因在该压强下铁触媒的活性最大
(3)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?
| 84(m1-m2) |
| 31m1 |
| 84(m1-m2) |
| 31m1 |
(4)硝酸厂的尾气中含有NO和NO2等污染物,常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去.写出甲烷与NO2反应的化学反应方程式:
若基于下列反应的方法治理:2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O;现有标准状况下NO、NO2的混合物恰好与50mL 2.0mol?L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为
(08枣庄三诊)氨在国民经济中占有重要的地位。现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料。例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法。
|
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
设备A的名称是 ,设备B的名称是 。
(2)硝酸厂的尾气中含有NO和NO2等污染物,籽了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:Na2CO3+2NO2====NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去。写出甲烷与NO2反应的化学反应方程式: 。
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染。可采用 法和 法进行改进。
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么 。
查看习题详情和答案>>

(2)有关合成氨工业的说法中,正确的是__________(填序号)。
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~5×107Pa,因在该压强下铁触媒的活性最大
(3)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?______(填“能”或“否”),为什么?________________________。若产品纯碱中含有碳酸氢钠,用加热分解的方法测定纯碱中碳酸氢钠的质量分 数,则其质量分数可表示为___________________________ (注明表达式中所用符号的含义)。
(4)硝酸厂的尾气中含有NO和NO2等污染物,常利用各种燃料气中的甲烷等将氮的氧化物还原为空气的主要成分而除去。写出甲烷与NO2反应的化学方程式:____________________。若基于下列反应的方法治理:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO+NO2+2NaOH=2NaNO2+H2O;标准状况下NO、NO2的混合物恰好与50 mL 2.0 mol/L的NaOH溶液完全反应,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO的体积分数为_________。
氨在国民经济中占有重要的地位.现在约有80%的氨用来制造化肥,其余的用作生产其他化工产品的原料.例如,农业上使用的氮肥如尿素、硝酸铵、磷酸铵、硫酸铵、氯化铵、氨水以及各种含氮混合肥料和复合肥料,都是以氨为原料制成的;氨氧化法制硝酸是工业上制硝酸的主要方法.
(1)下图是合成氨和利用氨制取硝酸、纯碱的简要流程示意图:
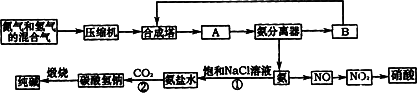
设备A的名称是________,设备B的名称是________.
(2)硝酸厂的尾气中含有NO和NO2等污染物,籽了防止污染大气可以用纯碱溶液吸收从吸收塔中放出的尾气,发生的反应如下:
Na2CO3+2NO2![]() NaNO2+NaNO3+CO2
NaNO2+NaNO3+CO2
但在实际生的中这种方法处理后尾气中的氮的氧化物含量仍难以降到排放标准,历此,也常利用各种燃料气中的甲烷等将氮的氧化物还原为空气主要成分而除去.写出甲烷与NO2反应的化学反应方程式:________.
(3)常压法生产出的硝酸浓度低,尾气中氮的氧化物含量高,对环境会有严重污染.可采用________法和________法进行改进.
(4)在纯碱制造过程中,过程①与过程②的顺序能否颠倒?为什么________.