摘要:00×10-3×0.2ml 0.4×0.2×11.00×10-3ml 用于与草酸钠反应的Mn4-为0.4×0.2×11.00×10-3=8.8×10-4ml.则与水样反应的Mn4-为10.00×10-3×0.1-8.8×10-4=1.2×10-4 ml.则换算成氧气 4Mn4- ~ 2 4
网址:http://m.1010jiajiao.com/timu3_id_72390[举报]
 我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示
我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示| 浓度限值(mg/m3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
(2010?南通模拟)SO2和NOx的排放是造成酸雨的两大罪魁祸首.如图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据.
(1)结合上图数据,判断下列说法正确的是
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少.请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
(3)汽车排放的尾气中含有未燃烧充分的CmHn、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO?N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
在上述条件下反应能够自发进行,则反应的△H
(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH=3.62[c(H+)=2.4×10-4mol/L]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g.若假设雨水的酸性仅由NOx和SO2的排放所致.请计算排放在空气中的NOx和SO2的物质的量之比接近于
查看习题详情和答案>>

(1)结合上图数据,判断下列说法正确的是
BD
BD
.A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少.请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
CaCO3+SO2=CaSO3+CO2或2CaCO3+2SO2+O2=2CaSO4+2CO2
CaCO3+SO2=CaSO3+CO2或2CaCO3+2SO2+O2=2CaSO4+2CO2
.(3)汽车排放的尾气中含有未燃烧充分的CmHn、以及N2、CO2、NO、CO等.有人设计利用反应2NO+2CO?N2+2CO2 将有害的污染物转化为可参与大气循环的N2和CO2.
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
<
<
0(“>”、“<”、“=”).在该温度下,反应的平衡常数K=5000
5000
.(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH=3.62[c(H+)=2.4×10-4mol/L]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g.若假设雨水的酸性仅由NOx和SO2的排放所致.请计算排放在空气中的NOx和SO2的物质的量之比接近于
1:1
1:1
.氢气被誉为21世纪的新型清洁能源,能有效降低二氧化碳的排放.以甲醇为原料经过重整可以获得氢气.其工业流程如下:
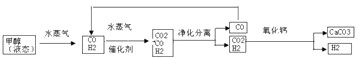
请回答以下问题:
(1)液态甲醇雾化后与水蒸气混合,其目的是 ;该工业流程中可以循环利用的物质是 (填名称).
(2)为了测定CH3OH(g)+H2O(g)→CO2(g)+3H2(g)的反应速率,在某温度下用气体传感器测得不同时间的甲醇和水蒸气浓度如下:
①前2s内的平均反应速率v(H2)=
②在该温度下,反应的平衡常数表达式K= .
(3)为了研究反应条件对CO含量的影响,在甲醇含量为50%,原料液进料量60mL/h的情况下,在常压下和在不同催化环境下得到了反应温度与CO含量的关系图.从图中得到的有关结论是 (写出其中一个即可)
(4)为研究反应中压强对CO含量的影响,请简述你的实验方案: .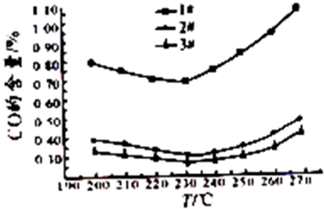
查看习题详情和答案>>

请回答以下问题:
(1)液态甲醇雾化后与水蒸气混合,其目的是
(2)为了测定CH3OH(g)+H2O(g)→CO2(g)+3H2(g)的反应速率,在某温度下用气体传感器测得不同时间的甲醇和水蒸气浓度如下:
| 时间 s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(CH3OH) /mol.L-1 |
1.00×10-3 | 4.50×10-4 | 2.5 0×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| C(H2O) mol.L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.7×10-3 | 2.7×10-3 |
②在该温度下,反应的平衡常数表达式K=
(3)为了研究反应条件对CO含量的影响,在甲醇含量为50%,原料液进料量60mL/h的情况下,在常压下和在不同催化环境下得到了反应温度与CO含量的关系图.从图中得到的有关结论是
(4)为研究反应中压强对CO含量的影响,请简述你的实验方案:

超音速飞机尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变为CO2和N2,化学方程式如下:
2NO+2CO
2CO2+N2 △H<0.
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
请回答(以下各题均不考虑温度变化对催化效率的影响):
(1)前2s内的平均反应速率v(N2)=
(2)在该温度下,反应的平衡常数K=
(3)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是
A.反应混合物各组分物质的量浓度相等
B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗1mol NO的同时,就有1mol CO生成
(4)达到平衡后下列能提高NO转化率的是
A.选用更有效的催化剂 B.保持容器体积不变充入氦气增大压强
C.降低反应体系的温度 D.缩小容器的体积
(5)反应2NO+O2═2NO2 △S<0能自发进行的原因是
(6)①液态肼(N2H4)和液态双氧水混合反应时,即产生大量氮气和水蒸汽,并放出大量的热.已知0.4mol 液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.6kJ的热量.该反应的热化学方程式是
②某燃料电池以肼作为燃料,写出酸性介质中肼参与反应的电极反应式:
查看习题详情和答案>>
2NO+2CO
| 催化剂 |
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)前2s内的平均反应速率v(N2)=
1.875×10-4mol/(L?s)
1.875×10-4mol/(L?s)
.(2)在该温度下,反应的平衡常数K=
5000
5000
.(3)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是
D
D
.A.反应混合物各组分物质的量浓度相等
B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗1mol NO的同时,就有1mol CO生成
(4)达到平衡后下列能提高NO转化率的是
CD
CD
.A.选用更有效的催化剂 B.保持容器体积不变充入氦气增大压强
C.降低反应体系的温度 D.缩小容器的体积
(5)反应2NO+O2═2NO2 △S<0能自发进行的原因是
反应是放热反应
反应是放热反应
.(6)①液态肼(N2H4)和液态双氧水混合反应时,即产生大量氮气和水蒸汽,并放出大量的热.已知0.4mol 液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.6kJ的热量.该反应的热化学方程式是
N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5kJ/mol
N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5kJ/mol
.②某燃料电池以肼作为燃料,写出酸性介质中肼参与反应的电极反应式:
N2H4-4e-═4H++N2
N2H4-4e-═4H++N2
.(2011?上海模拟)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO?2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应是
(2)前2s内的平均反应速度v(N2)=
(3)此反应的平衡常数表达式为K=
.
(4)假设在容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积.
查看习题详情和答案>>
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应是
放热
放热
反应(填写“吸热”、“放热”).(2)前2s内的平均反应速度v(N2)=
1.875×10-4mol/L?s
1.875×10-4mol/L?s
.(3)此反应的平衡常数表达式为K=
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
| c(N2)c2(CO2) |
| c2(CO)c2(NO) |
(4)假设在容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是
CD
CD
.A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积.