题目内容
氢气被誉为21世纪的新型清洁能源,能有效降低二氧化碳的排放.以甲醇为原料经过重整可以获得氢气.其工业流程如下:
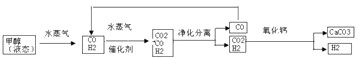
请回答以下问题:
(1)液态甲醇雾化后与水蒸气混合,其目的是 ;该工业流程中可以循环利用的物质是 (填名称).
(2)为了测定CH3OH(g)+H2O(g)→CO2(g)+3H2(g)的反应速率,在某温度下用气体传感器测得不同时间的甲醇和水蒸气浓度如下:
①前2s内的平均反应速率v(H2)=
②在该温度下,反应的平衡常数表达式K= .
(3)为了研究反应条件对CO含量的影响,在甲醇含量为50%,原料液进料量60mL/h的情况下,在常压下和在不同催化环境下得到了反应温度与CO含量的关系图.从图中得到的有关结论是 (写出其中一个即可)
(4)为研究反应中压强对CO含量的影响,请简述你的实验方案: .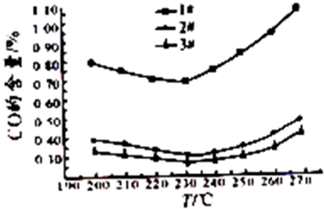

请回答以下问题:
(1)液态甲醇雾化后与水蒸气混合,其目的是
(2)为了测定CH3OH(g)+H2O(g)→CO2(g)+3H2(g)的反应速率,在某温度下用气体传感器测得不同时间的甲醇和水蒸气浓度如下:
| 时间 s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(CH3OH) /mol.L-1 |
1.00×10-3 | 4.50×10-4 | 2.5 0×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| C(H2O) mol.L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.7×10-3 | 2.7×10-3 |
②在该温度下,反应的平衡常数表达式K=
(3)为了研究反应条件对CO含量的影响,在甲醇含量为50%,原料液进料量60mL/h的情况下,在常压下和在不同催化环境下得到了反应温度与CO含量的关系图.从图中得到的有关结论是
(4)为研究反应中压强对CO含量的影响,请简述你的实验方案:

分析:(1)液态甲醇雾化后与水蒸气混合,增大反应物的接触面积,加快反应;
工业流程中前面用到的物质在后续过程中又生成该物质,则该物质可以循环利用,结合工业流程解答;
(2)①根据v=
计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
②化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(3)CO的含量越低越好,据此结合图象解答;
(4)采用控制变量法设计,其它条件不变,测定不同压强下CO含量.
工业流程中前面用到的物质在后续过程中又生成该物质,则该物质可以循环利用,结合工业流程解答;
(2)①根据v=
| △c |
| △t |
②化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(3)CO的含量越低越好,据此结合图象解答;
(4)采用控制变量法设计,其它条件不变,测定不同压强下CO含量.
解答:解:(1)液态甲醇雾化后与水蒸气混合,增大反应物的接触面积,加快反应速率;
由工业流程可知,循环利用的物质是CO,
故答案为:增大反应物的接触面积,加快反应速率;CO;
(2)①由表中数据可知,△c(CH3OH)=1×10-3mol/L-2.5×10-4mol/L=7.5×10-4mol/L,
故v(CH3OH)=
=3.75×10-4mol/(L?s),速率之比等于化学计量数之比,故
v(H2)=3v(CH3OH)=3×3.75×10-4mol/(L?s)=1.125×10-3mol/(L?s)=,
故答案为:1.125×10-3mol/(L?s);
②CH3OH(g)+H2O(g)?CO2(g)+3H2(g)的化学平衡常数k=
,
故答案为:
;
(3)CO的含量越低越好,由图象可知,温度在230℃时CO的含量最低,故最佳反应温度为230℃,
故答案为:最佳反应温度为230℃;
(4)采用控制变量法设计,其它条件不变,测定不同压强下CO含量,故实验方案为:在甲醇含量为50%,原料液进料量60mL/h,温度一定情况下,测定不同压强下CO含量,
故答案为:在甲醇含量为50%,原料液进料量60mL/h,温度一定情况下,测定不同压强下CO含量.
由工业流程可知,循环利用的物质是CO,
故答案为:增大反应物的接触面积,加快反应速率;CO;
(2)①由表中数据可知,△c(CH3OH)=1×10-3mol/L-2.5×10-4mol/L=7.5×10-4mol/L,
故v(CH3OH)=
| 7.5×10-4mol/L |
| 2s |
v(H2)=3v(CH3OH)=3×3.75×10-4mol/(L?s)=1.125×10-3mol/(L?s)=,
故答案为:1.125×10-3mol/(L?s);
②CH3OH(g)+H2O(g)?CO2(g)+3H2(g)的化学平衡常数k=
| c3(H2)?c(CO2) |
| c(CH3OH)?c(H2O) |
故答案为:
| c3(H2)?c(CO2) |
| c(CH3OH)?c(H2O) |
(3)CO的含量越低越好,由图象可知,温度在230℃时CO的含量最低,故最佳反应温度为230℃,
故答案为:最佳反应温度为230℃;
(4)采用控制变量法设计,其它条件不变,测定不同压强下CO含量,故实验方案为:在甲醇含量为50%,原料液进料量60mL/h,温度一定情况下,测定不同压强下CO含量,
故答案为:在甲醇含量为50%,原料液进料量60mL/h,温度一定情况下,测定不同压强下CO含量.
点评:本题考查化学反应速率计算、化学平衡常数、对实验条件的控制探究等,难度中等,注意利用控制变量法进行方案设计.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
硅被誉为无机非金属材料的主角.据2001年12月的《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”.下列有关说法正确的是( )
| A、硅在地壳中含量居第二位,在地球上有丰富的硅资源,如石英、水晶、玛瑙的主要成分都是单质硅 | B、硅相对于氢气便于运输、贮存,从安全角度考虑,硅是有开发价值的燃料 | C、存放NaOH溶液的试剂瓶应用玻璃塞 | D、硅是一种良好的半导体材料,所以是制造光导纤维的基本原料 |
硅被誉为无机非金属材料的主角。据2001年12月的《参考消息》报道,有科学家提出硅是“21世纪的能源”“未来的石油”。下列有关说法正确的是
| A.硅的含量居第二位,在地球上有丰富的单质硅资源,如石英、水晶、玛瑙的主要成分都是单质硅 |
| B.硅相对于氢气便于运输、贮存,从安全角度考虑,硅是有开发价值的燃料 |
| C.存放NaOH溶液的试剂瓶应用细口玻璃瓶并配磨口玻璃塞 |
| D.硅是一种良好的半导体材料,所以是制造光导纤维的基本原料 |