网址:http://m.1010jiajiao.com/timu3_id_72361[举报]
A.Fe3+ B.MnO![]()
C.Cl2 D.HNO2
查看习题详情和答案>>
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是: 。(用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:(注:褪色原因只有一种)
①溴与乙醛发生取代反应;② ;③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了
如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br—离子的物质的量。
(3)根据方案一,若 ,则猜想②不成立。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br—)= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。若已知CH3COOAg易溶于水。
试通过计算判断:溴与乙醛发生反应的化学方程式为 ;
小张同学认为合适的酸既不是硫酸也不是盐酸,这是为什么? 。
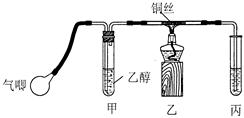
Ⅱ.小钱同学利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。

请填写下列空白:
(1)乙醇发生催化氧化的化学方程式为 。
(2)实验时,小钱同学将甲装置浸在70℃~80℃的水浴中,目的是 _。
小孙同学认为:由于小钱同学装置设计上的缺陷,实验进行时可能会 ____________。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步探究表明,鼓气速度与反应体系的温度关系曲线如图所示。

请你解释鼓气速度过快,反应体系温度反而下降的原因是: 。
你认为该实验中“鼓气速度”这一变量可用 来计量。
查看习题详情和答案>>
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是: 。(用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:(注:褪色原因只有一种)
①溴与乙醛发生取代反应;② ;③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了
如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br—离子的物质的量。
(3)根据方案一,若 ,则猜想②不成立。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br—)= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。若已知CH3COOAg易溶于水。
试通过计算判断:溴与乙醛发生反应的化学方程式为 ;
小张同学认为合适的酸既不是硫酸也不是盐酸,这是为什么? 。
Ⅱ.小钱同学利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。
请填写下列空白:
(1)乙醇发生催化氧化的化学方程式为 。
(2)实验时,小钱同学将甲装置浸在70℃~80℃的水浴中,目的是 _。
小孙同学认为:由于小钱同学装置设计上的缺陷,实验进行时可能会 ____________。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步探究表明,鼓气速度与反应体系的温度关系曲线如图所示。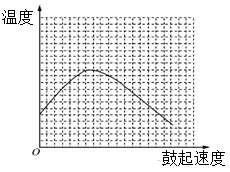
请你解释鼓气速度过快,反应体系温度反而下降的原因是: 。
你认为该实验中“鼓气速度”这一变量可用 来计量。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是: 。(用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:(注:褪色原因只有一种)
①溴与乙醛发生取代反应;② ;③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了
如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br—离子的物质的量。
(3)根据方案一,若 ,则猜想②不成立。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br—)= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。若已知CH3COOAg易溶于水。
试通过计算判断:溴与乙醛发生反应的化学方程式为 ;
小张同学认为合适的酸既不是硫酸也不是盐酸,这是为什么? 。
Ⅱ.小钱同学利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。
请填写下列空白:
(1)乙醇发生催化氧化的化学方程式为 。
(2)实验时,小钱同学将甲装置浸在70℃~80℃的水浴中,目的是 _。
小孙同学认为:由于小钱同学装置设计上的缺陷,实验进行时可能会 ____________。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步探究表明,鼓气速度与反应体系的温度关系曲线如图所示。
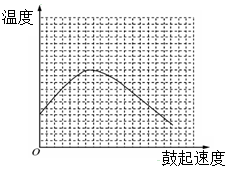
请你解释鼓气速度过快,反应体系温度反而下降的原因是: 。
你认为该实验中“鼓气速度”这一变量可用 来计量。
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①写出反应I中主要发生的氧化还原反应的离子方程式
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为
 [Fe2(OH)4]2++2H+
[Fe2(OH)4]2++2H+ [Fe2(OH)4]2++2H+
[Fe2(OH)4]2++2H+II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li
| ||