题目内容
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是: 。(用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:(注:褪色原因只有一种)
①溴与乙醛发生取代反应;② ;③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了
如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br—离子的物质的量。
(3)根据方案一,若 ,则猜想②不成立。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br—)= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。若已知CH3COOAg易溶于水。
试通过计算判断:溴与乙醛发生反应的化学方程式为 ;
小张同学认为合适的酸既不是硫酸也不是盐酸,这是为什么? 。
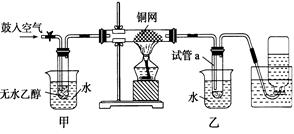
Ⅱ.小钱同学利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。
请填写下列空白:
(1)乙醇发生催化氧化的化学方程式为 。
(2)实验时,小钱同学将甲装置浸在70℃~80℃的水浴中,目的是 _。
小孙同学认为:由于小钱同学装置设计上的缺陷,实验进行时可能会 ____________。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步探究表明,鼓气速度与反应体系的温度关系曲线如图所示。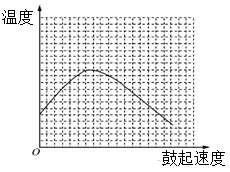
请你解释鼓气速度过快,反应体系温度反而下降的原因是: 。
你认为该实验中“鼓气速度”这一变量可用 来计量。
I.(1)银氨溶液,出现银镜或新制氢氧化铜悬浊液,产生砖红色沉淀。(2分)
(2)②溴与乙醛发生加成反应 (2分)
(3)若用pH试纸检测褪色后溶液的酸性明显增强,则猜想②不成立(2分)
(4)a (2分) (5)CH3CHO+Br2+H2O→CH3COOH+2HBr (2分)
Cl- 、SO42-与过量的Ag+作用也产生沉淀,干扰实验的进行。 (2分)
Ⅱ.(1)2CH3CH2OH+O2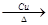 2CH3CHO+2H2O (2分)
2CH3CHO+2H2O (2分)
(2)使生成乙醇蒸气的速率加快且较均匀 发生倒吸 (2分)
(3)过量的气体将体系中的热量带走 (2分) 单位时间内甲中的气泡数 (1分)
解析试题分析:I.(1)乙醇催化氧化生成乙醛,乙醛中含有醛基,因此可以通过检验醛基来检验生成物,所以需要的试剂是银氨溶液或新制的氢氧化铜悬浊液,实验现象是出现银镜或产生砖红色沉淀。
(2)溴水褪色,这说明反应中单质溴被消耗。由于乙醛分子中含有甲基和醛基,所以可逆的原因是①溴与乙醛发生取代反应;②溴与乙醛发生加成反应;③由于醛基具有还原性,溴将乙醛氧化为乙酸。
(3)如果溴单质与醛基发生加成反应,则溶液的酸性降低。如果与甲基发生取代反应,则溶液的酸性增强。所以根据方案一,若用pH试纸检测褪色后溶液的酸性明显增强,则猜想②不成立。
(4)如果发生的是取代反应,则必然生成溴化氢,因此根据溴原子守恒可知,反应后的溶液中如果n(Br—)=amol,则说明溴与乙醛发生取代反应。
(5)已知CH3COOAg易溶于水,这说明生成的淡黄色沉淀应该是溴化银,物质的量=0.188g=188g/mol=0.001mol.反应前溶液中单质溴的物质的量=0.5mol×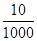 ×
× =0.0005mol,其中溴原子的物质的量=0.0005mol×2=0.001mol,恰好等于生成的溴化银的物质的量,这说明单质溴与乙醛发生的是氧化反应,反应的方程式为CH3CHO+Br2+H2O→CH3COOH+2HBr。由于Cl- 、SO42-与过量的Ag+作用也产生沉淀,干扰实验的进行,所以合适的酸不是硫酸也不是盐酸。
=0.0005mol,其中溴原子的物质的量=0.0005mol×2=0.001mol,恰好等于生成的溴化银的物质的量,这说明单质溴与乙醛发生的是氧化反应,反应的方程式为CH3CHO+Br2+H2O→CH3COOH+2HBr。由于Cl- 、SO42-与过量的Ag+作用也产生沉淀,干扰实验的进行,所以合适的酸不是硫酸也不是盐酸。
Ⅱ.(1)乙醇再催化剂的作用下发生催化氧化生成乙醛和水,反应的化学方程式为2CH3CH2OH+O2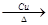 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(2)反应中需要乙醇气体,而乙醇的沸点大约是78℃,所以实验时,小钱同学将甲装置浸在70℃~80℃的水浴中,目的是使生成乙醇蒸气的速率加快且较均匀;由于乙醇以及生成的乙醛都是与水互溶的,因此丙装置中导管直接插入到溶液中容易发生倒吸。
(3)如果鼓起速度过快,则过量的气体将体系中的热量带走,从而使温度降低;由于气体溶于水会产生气泡,所以该实验中“鼓气速度”这一变量可用单位时间内甲中的气泡数来计量。
考点:考查溴水与乙醛反应原理的实验探究以及乙醇的催化氧化实验方案设计与评价

在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%,下列反应类型能体现“绿色化学工艺”的是
| A.化合反应 | B.复分解反应 | C.分解反应 | D.取代反应 |
下列反应中,属于取代反应的是
| A.CH3CH=CH2+Br2→CH3CHBrCH2Br |
B.2CH3CH2OH + O2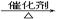 2CH3CHO+2H2O 2CH3CHO+2H2O |
C.CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O |
D.CH3CH2OH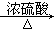 CH2=CH2↑+H2O CH2=CH2↑+H2O |




 D.CH3COOH®CH3COOC2H5
D.CH3COOH®CH3COOC2H5