摘要:在比例尺为1:100 000的霍邱县地图上.水门塘的周长约为12cm.面积约为3.2cm2.则水门塘的实际周长和面积大约分别是( ) A.1.2km.3.2 km2 C.12km.32 km2 B.12km.3.2km2 D.12km.320km2
网址:http://m.1010jiajiao.com/timu3_id_7214[举报]
 请根据下面有关信息,按题目要求回答问题:
请根据下面有关信息,按题目要求回答问题:(1)将放浓硫酸的试剂瓶露置在空气中一段时间后溶液的质量分数会
变小
变小
(填变大或变小)(2)某厂以流量10L.s-1排出含硫酸9.8%的工业废水,现往该废水中排入含氢氧化钠2%的工业废水将其酸性中和后再排出.要使处理后的废水pH约为7,则氢氧化钠的流量应当为
40L.s-1
40L.s-1
(假设含酸废水的密度和含碱废水的密度约为1g.cm-3)(3)四种氮肥:(NH4)2SO4、NH4HCO3、NH4NO3、CO(NH2)2(尿素),含氮量最低是
碳酸氢铵
碳酸氢铵
(填名称)(4)为检验糖尿病患者的尿液,医院要配置8%的CuSO4溶液.现有16g硫酸铜同体,可配置该硫酸铜溶液
200
200
g,需水184
184
ml(水的密度为1.0g.cm-3).(5)火力发电厂用石灰浆吸收废气中的二氧化硫,以防止污染环境,其发生发应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2.若100克废气中含有1.6克二氧化硫,则处理1000克这种废气需要含碳酸钙80%的石灰石
31.3或31.25
31.3或31.25
克.(6)某校化学兴趣小组为测定某硝酸铵样品的纯度,将样品溶于水后,再加入氢氧化钠浓溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠的反应方程式为:NH4NO3+NaOH
| ||
. |
| 时间/s | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加的质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
(b)表中m约为
1.0
1.0
.(2013?东营)化肥对提高农作物的产量具有重要的作用,碳铵(碳酸氢铵)就是农民朋友经常使用的一种氮肥,碳铵易溶于水、受潮时常温分解,温度越高分解越快,遇碱时放出氨气.某校化学兴趣小组为测定某碳铵肥料样品的纯度,将8.5g样品加入足量的浓氢氧化钠溶液中共热,(碳铵中的杂质不与氢氧化钠反应,反应的方程式为NH4HCO3+2NaOH=Na2CO3+2H2O+NH3↑),把产生的所有NH3用足量的硫酸溶液吸收,同时测量两分钟内硫酸溶液增加的质量,结果如下表所示.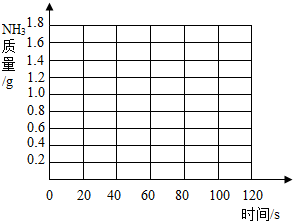
试回答下列问题:
(1)根据碳酸氢铵的性质,你认为在使用碳铵肥料时应注意的问题是
(2)请在如图所示的坐标纸上,以反应时间为横坐标,以产生NH3质量为纵坐标,画出产生气体的质量随时间变化的关系曲线,并判断表中m约为
(3)试计算该样品中碳酸氢铵的质量分数(写出计算过程,计算结果保留一位小数).
查看习题详情和答案>>

| 时间/S | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
(1)根据碳酸氢铵的性质,你认为在使用碳铵肥料时应注意的问题是
储存和运输时要密封,不要受潮或暴晒;施用后要盖土或立即灌溉;不要与碱性物质混用
储存和运输时要密封,不要受潮或暴晒;施用后要盖土或立即灌溉;不要与碱性物质混用
.(2)请在如图所示的坐标纸上,以反应时间为横坐标,以产生NH3质量为纵坐标,画出产生气体的质量随时间变化的关系曲线,并判断表中m约为
1.0
1.0
.(3)试计算该样品中碳酸氢铵的质量分数(写出计算过程,计算结果保留一位小数).
(2013?天桥区二模)自来水生产中通常用适量的氯气杀菌消毒,以食盐(NaCl)为原料制取氯气的流程如如图所示.
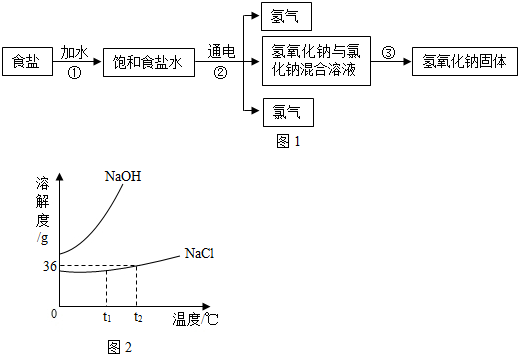
根据题意填写下列空白:
(1)上述过程中的涉及的物质属于盐的是
(2)过程②发生反应的化学方程式为2NaCl+2X
2NaOH+H2↑+Cl2↑,其中X的化学式为
(3)氯化钠和氢氧化钠溶解度曲线如图所示,温度为t2时,过程①要将18g氯化钠配制成饱和溶液,需要水的质量为
查看习题详情和答案>>

根据题意填写下列空白:
(1)上述过程中的涉及的物质属于盐的是
NaCl
NaCl
(写化学式).(2)过程②发生反应的化学方程式为2NaCl+2X
| ||
H2O
H2O
,在反应前后Cl元素的化合价分别为-1和0
-1和0
价.(3)氯化钠和氢氧化钠溶解度曲线如图所示,温度为t2时,过程①要将18g氯化钠配制成饱和溶液,需要水的质量为
50
50
g;过程③要得到氢氧化钠固体所采取的方法为降温结晶
降温结晶
.(2009?昌平区二模)某校化学兴趣小组为测定某硝酸铵样品的纯度,将10g样品溶于30g水后,再加入13.7g氢氧化钠浓溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠的反应方程式为:NH4NO3+NaOH
NaNO3+H2O+NH3↑).把产生的所有NH3用足量的硫酸溶液吸收,同时测量2分钟内硫酸溶液增加的质量,结果如下表所示:
试回答下列问题:
(1)表中m约为
(2)硝酸铵样品的纯度为
(3)试计算反应后所得硝酸钠溶液的溶质质量分数(不考虑反应过程中水损失的质量).
查看习题详情和答案>>
| ||
| 时间/s | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加的质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
(1)表中m约为
1.0
1.0
.(2)硝酸铵样品的纯度为
80%
80%
.(3)试计算反应后所得硝酸钠溶液的溶质质量分数(不考虑反应过程中水损失的质量).