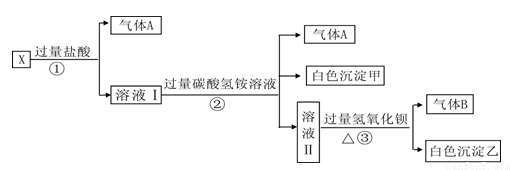
摘要:16.某无色溶液X.由Na+.Ag+.Ba2+.Al3+.AlO.MnO.CO.SO中的若干种离子组成.取溶液进行如下连续实验: (1)气体A的成分是 .气体B的成分是 . (2)X溶液中一定存在的离子是 . (3)写出步骤①发生反应的所有离子方程式 . (4)写出步骤②形成白色沉淀甲的离子方程式 . (5)通过上述实验.溶液X中还有未完全确定的离子是 ,只要设计一个简单的后续实验就可以确定该离子是否存在.该方法是 . 解析:由于溶液是无色的.所以排除MnO的存在,溶液X中加入HCl有气体生成.说明有CO的存在.生成气体A为CO2,CO的存在排除了Ag+.Ba2+.Al3+的存在,第②步继续向反应后的溶液中加入NH.反应既生成气体.又生成沉淀.所以证明原溶液含有AlO.AlO在第一步加入HCl时发生反应AlO+4H+===Al3++2H2O.生成的Al3+和HCO发生相互促进水解反应,Al3++3HCO===Al(OH)3↓+3CO2↑,第③步继续加入Ba(OH)2.生成白色沉淀.可能含有BaCO3或BaSO4中的一种或两种.用盐酸检验. 答案:(1)CO2 NH3 (2)CO.AlO.Na+ (3)CO+2H+===H2O+CO2↓ AlO+4H+===Al3++2H2O (4)Al3++3HCO===Al(OH)3↓+3CO2↑ (5)SO 在沉淀乙中加稀盐酸.若白色沉淀能完全溶解.则X中不存在SO,若不能完全溶解.则存在SO
网址:http://m.1010jiajiao.com/timu3_id_72136[举报]
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、Fe3+、AlO2-、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验:
(1)气体A的成分是
(2)写出步骤①发生反应的所有离子方程式
(3)写出步骤②形成白色沉淀甲的离子方程式
(4)通过上述实验,可确定X溶液中一定存在的离子是
查看习题详情和答案>>

(1)气体A的成分是
CO2
CO2
(填化学式,下同),气体B的成分是NH3
NH3
.(2)写出步骤①发生反应的所有离子方程式
CO32-+2H+═H2O+CO2↑
CO32-+2H+═H2O+CO2↑
.(3)写出步骤②形成白色沉淀甲的离子方程式
AlO2-+4H+═Al3++2H2O,Al3++3HCO3-═Al(OH)3↓+3CO2↑
AlO2-+4H+═Al3++2H2O,Al3++3HCO3-═Al(OH)3↓+3CO2↑
.(4)通过上述实验,可确定X溶液中一定存在的离子是
CO32-,AlO2-,Na+
CO32-,AlO2-,Na+
,尚未确定是否存在的离子是SO42-
SO42-
,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是向所得沉淀乙中滴加足量的稀硝酸,若沉淀不完全溶解,则证明含有SO42-
向所得沉淀乙中滴加足量的稀硝酸,若沉淀不完全溶解,则证明含有SO42-
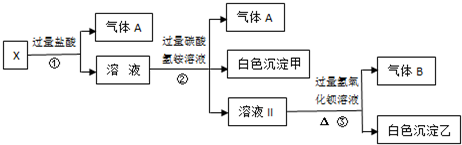
.某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验:

(1)白色沉淀甲是
(2)X溶液中一定存在的离子是
(3)白色沉淀乙中一定有:
(4)若将过量的气体A与适量的气体B通入水中,写出反应的离子方程式
查看习题详情和答案>>

(1)白色沉淀甲是
Al(OH)3
Al(OH)3
.(2)X溶液中一定存在的离子是
CO32-;AlO2-;Na+;
CO32-;AlO2-;Na+;
.(3)白色沉淀乙中一定有:
BaCO3
BaCO3
,可能有BaSO4
BaSO4
证明其是否存在的方法是取少量沉淀放在试管中,加入硝酸,沉淀部分溶解,证明沉淀中含硫酸钡,沉淀全部溶解在,不含硫酸钡沉淀
取少量沉淀放在试管中,加入硝酸,沉淀部分溶解,证明沉淀中含硫酸钡,沉淀全部溶解在,不含硫酸钡沉淀
.(4)若将过量的气体A与适量的气体B通入水中,写出反应的离子方程式
CO2+NH3+H2O=NH4++HCO3-
CO2+NH3+H2O=NH4++HCO3-
.某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种离子组成,取溶液进行如下连续实验:
(1)白色沉淀甲是 _________。
(2)X溶液中一定存在的离子是_____________。
(3)白色沉淀乙中一定有:______,可能有_______ 证明其是否存在的方法是______________。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的离子方程式_____________。
查看习题详情和答案>>
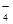 、CO
、CO 、MnO
、MnO 、CO
、CO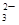 、SO
、SO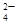 中的若干种离子组成,取溶液进行如下连续实验:
中的若干种离子组成,取溶液进行如下连续实验: