摘要:15.某温度下.将Cl2通入NaOH溶液中.反应得到NaCl.NaClO.NaClO3的混合液.经测定ClO-与ClO的物质的量浓度之比为1?3.则Cl2与NaOH溶液反应时.被还原的氯元素与被氧化的氯元素的物质的量之比为 ( ) A.21:5 B.11:3 C.3:1 D.4:1 解析:根据题意Cl2与NaOH反应.Cl2既被氧化又被还原.被氧化的氯元素的产物ClO-.ClO的物质的量之比为1?3.被还原的氯元素的产物是Cl-.可根据氧化还原反应得失电子守恒进行求解.若反应中生成1 mol ClO-.氯元素失去1 mol电子.生成3 mol ClO.失去15 mol电子.即共失去16 mol电子.则必有16 mol的氯原子被还原成Cl-.所以.被还原的氯元素与被氧化的氯元素的物质的量之比为16 mol?=4?1. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_72095[举报]
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液。经测定ClO-与 的浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为( )
的浓度之比为1∶3,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为( )
A.21∶5 B.11∶3 C.3∶1 D.4∶1
查看习题详情和答案>>
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO 的浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为
的浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为
A.21∶5 B.11∶3
C.3∶1 D.4∶1
查看习题详情和答案>>
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO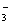 的浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )?
的浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )?
A.21∶5 B.11∶3? C.3∶1 D.4∶1
查看习题详情和答案>>