摘要:A.B.C.D.E.F六种物质有如下变化关系.E是淡黄色粉末.判断: (1)写出A.B.C.D.E.F的化学式: A. .B. .C. .D. . E. .F. . (2)写出有关反应的化学方程式(是离子反应的直接写离子方程式) B→C: . E→B: . C→F: . F→C: .
网址:http://m.1010jiajiao.com/timu3_id_71776[举报]
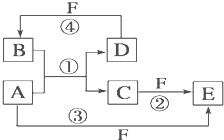 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属单质(一种黑色固体),且所含元素的原子序数A是D的2倍,原子的最外层电子数D是A的2倍,化合物F的浓溶液与单质A、D在一定条件下反应都有红棕色气体生成,则A在周期表中的位置为:
第三周期,ⅡA族
第三周期,ⅡA族
,B的电子式为::O::C::O:
:O::C::O:
,F的浓溶液与D在加热条件下反应的化学方程式为:C+4HNO3
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3
CO2↑+4NO2↑+2H2O
.
| ||
(2)若A是常见变价金属的单质,D、F是气态单质,且反应①②均在水溶液中进行.则反应②的离子方程式是
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(3)若A、D、F都是短周期非金属元素单质,且 A、D所含元素同主族,A、F所含元素同周期,B是制作光导纤维的基本原料,则B是
SiO2
SiO2
,C是CO
CO
,F是O2
O2
.(填化学式)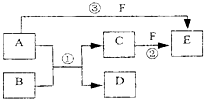 A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应,B、C、F都是气态单质,且B为黄绿色;反应③中有水生成,反应②需要放电才能发生,A和 D相遇有白烟生成.
(1)反应③的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;
| ||
| △ |
(2)反应①中每生成1mol C,转移的电子数为
3.612×1024
3.612×1024
;(3)A与D的水溶液恰好完全反应时,其生成物的水溶液呈
酸
酸
性(填“酸”“碱”或“中”),该水溶液中存在着如下关系,用粒子浓度符号填写:①c(H+)+
c(NH4+)
c(NH4+)
=c(OH-)+c(Cl-)
c(Cl-)
;②c(H+)=c(OH-)+
c(NH3?H2O)
c(NH3?H2O)
.(4)元素x与组成B的元素同周期,x的单质既可与酸反应也可与碱反应且都生成H2,则
①X的单质与碱反应的离子方程式
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
;②X、空气、海水可以组成新型海水标志灯的电池.该种灯以海水为电解质溶液,靠空气中的氧气使X不断氧化而源源不断产生电流,只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍.则该新型电池的正极的电极反应式为
O2+H2O+4e-=4OH-
O2+H2O+4e-=4OH-
;原电池的总反应方程式为4Al+3O2+6H2O=4Al(OH)3
4Al+3O2+6H2O=4Al(OH)3
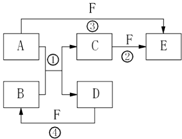
. A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)(1)若A是常见金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时发出苍白色火焰.则F所对应的元素在周期表位置是
第三周期、第ⅦA族
第三周期、第ⅦA族
,反应②(在水溶液中进行)的离子方程式为2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
;(2)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,且③④两个反应都有红棕色气体生成,则反应①、④的化学方程式分别为
①
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
,
| ||
④
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
;
| ||
(3)若A、D、F都是短周期非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C是一种能与血红蛋白结合的有毒气体;则物质B的晶体类型是
原子晶体
原子晶体
,分子E的结构式是O=C=O
O=C=O
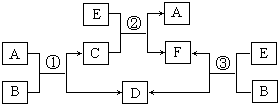
. A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件及部分产物未列出).
A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件及部分产物未列出).(1)若A是常见金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时发出苍白色火焰.则反应②(在水溶液中进行)的离子方程式为
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(2)若A、D为短周期元素组成的固体单质,一种为金属,另一种为非金属.且③④两个反应都有红棕色气体生成,则反应④的化学方程式为
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
(3)若A是黑色固体,D是有臭鸡蛋气味的气体,E溶液中滴加KSCN溶液呈血红色.则D的电子式是


4FeS2+11O2
2Fe2O3+8SO2
| ||
4FeS2+11O2
2Fe2O3+8SO2
,使用的设备是
| ||
沸腾炉
沸腾炉
.(4)若B是由地壳中含量最高的两种元素组成,A的一种同素异形体与B、D属同一种类型的晶体,则反应①的化学方程式是
2C+SiO2
Si+2CO↑
| ||
2C+SiO2
Si+2CO↑
,B与烧碱溶液反应的化学方程式是
| ||
SiO2+2NaOH=Na2SiO3+H2O
SiO2+2NaOH=Na2SiO3+H2O
. A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.(1)若反应①②③均为溶液中的置换反应,A、D、E为卤素单质,且通常状况下A为液态非金属单质,B的焰色反应为黄色,则根据反应①.②.③比较相关物质的氧化性由强到弱的顺序为
E>A>D
E>A>D
(用字母A.B.C…表示);反应①的化学方程式为Cl2+2NaI=2NaCl+I2
Cl2+2NaI=2NaCl+I2
.反应②的离子方程式为Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
.(2)若B是一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D.E的循环,写下列物质的化学式:A
H2O
H2O
ECO2
CO2
FNa2CO3
Na2CO3
,则反应①的化学方程式为2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.在反应③中若生成1molD,则转移的电子数目为2NA
2NA
.