摘要: 工业上可利用合成气(CO和H2的混合气体)生产甲醇.已知: ①CO(g)+O2(g)=CO2(g) △H=-283.0kJ/mol ②H2(g)+O2(g)=H2O(l) △H=-285.8kJ/mol ③CH3OH(g)+O2(g)=H2O(l) △H=-761.7kJ/mol ④CO(g)+2H2(g)CH3OH(g) (1)反应④的△H= .△S 0. (2)在一定条件下.反应④在一密闭容器中达到平衡.维持H2浓度和容器的温度不变.增大容器的体积.平衡将 . A. 向正反应方向移动 B. 向逆反应方向移动 C. 不移动 D. 无法判断 (3)工业上用反应④低压合成甲醇.在230℃-270℃最为有利.为研究合成气最合适的起始组成比.分别在230℃.250℃和270℃进行实验.结果如下图.230℃的实验结果所对应的曲线是 ,工业生产适宜采用的合成气组成比n(H2)∶n(CO)的范围应是 . A. 1∶1-1.5∶1 B. 2.2∶1-3∶1 C. 3.5∶1-4.5∶1 (4)原料气中含有少量CO2对CO合成甲醇的转化率有一定影响.科学家为研究这一影响.在同一容器中分别进行以下5组实验. 组别 原料气各组分的体积分数(%) CO CO2 H2 N2 第1组 19.7 0.0 59.1 21.2 第2组 20.7 0.3 62.1 16.9 第3组 16.9 1.3 50.7 31.1 第4组 19.8 5.5 59.4 15.3 第5组 20.3 10.9 60.9 7.9 表中5组实验中.控制不变的实验条件是压强.催化剂. . 等.
网址:http://m.1010jiajiao.com/timu3_id_71738[举报]
工业上可利用合成气(CO和H2的混合气体)生产甲醇(如反应④).已知:
①CO(g)+
O2(g)=CO2(g)△H=-283.0kJ/mol
②H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
③CH3OH(g)+
O2(g)=H2O(l)△H=-761.7kJ/mol
④CO(g)+2H2(g)=CH3OH(g)
(1)反应④的△H=
(2)反应④中当CO(g)和H2(g) 起始浓度相同时,平衡常数K值越大,表明
a.反应物的转化率越高 b.反应进行得越完全
c.达到平衡时反应物的浓度越大 d.化学反应速率越快
(3)在一定条件下,反应④在一密闭容器中达到平衡.维持H2浓度和容器的温度不变,增大容器的体积,平衡将
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断
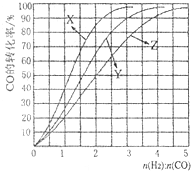
(4)工业上用反应④低压合成甲醇,在230℃~270℃最为有利.为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如右图.230℃的实验结果所对应的曲线是
查看习题详情和答案>>
①CO(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CH3OH(g)+
| 3 |
| 2 |
④CO(g)+2H2(g)=CH3OH(g)
(1)反应④的△H=
-92.9 KJ/mol
-92.9 KJ/mol
,△S<
<
0 (填“>”“<”或“=”).(2)反应④中当CO(g)和H2(g) 起始浓度相同时,平衡常数K值越大,表明
ab
ab
(填序号); a.反应物的转化率越高 b.反应进行得越完全
c.达到平衡时反应物的浓度越大 d.化学反应速率越快
(3)在一定条件下,反应④在一密闭容器中达到平衡.维持H2浓度和容器的温度不变,增大容器的体积,平衡将
B
B
(填字母).A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断

(4)工业上用反应④低压合成甲醇,在230℃~270℃最为有利.为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如右图.230℃的实验结果所对应的曲线是
X
X
(填字母).(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
  时间/min 时间/min物质 浓度 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
| H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |
②3min时改变的反应条件是____________________(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X1____X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1_______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式_______________________________________
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ____。 查看习题详情和答案>>
(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①3—4min之间,化学平衡向___ ____反应方向移动(填“正”或“逆”)。
②3min时改变的反应条件是____________________(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X1____X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1_______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式_______________________________________
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ____。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
  时间/min 时间/min物质 浓度 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
| H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |
②3min时改变的反应条件是____________________(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X1____X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1_______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式_______________________________________
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ____。
 工业上常利用CO和H2合成可再生能源甲醇.
工业上常利用CO和H2合成可再生能源甲醇.(1)已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ?mol-1和726.5kJ?mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为
(2)合成甲醇的方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.在230℃?270℃最为有利.为研究合成气最合适的起始组成比n(H2):n(CO),分别在230℃、250℃和270℃进行实验,结果如图所示.其中270℃的实验结果所对应的曲线是
(3)当投料比为1:1,温度为230℃,平衡混合气体中,CH3OH的物质的量分数为
工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。已知H2(g)、CO(g)和CH3OH(1)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol。请回答下列问题:
CO+2H2的方法来制取高纯度的CO和H2。已知H2(g)、CO(g)和CH3OH(1)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol。请回答下列问题:
(1)反应CH3OH(1)=CO(g)+2H2(g)的△H=__________kJ/mol。
(2)标准状况下33.6LCO、H2的混合气体与足量氧气充芬反应后,将生成的CO2和水蒸气通入足量的Na2O2后,固体质量增加30.0g,则CO、H2的混合气体的平均相对分子质量为____________________________。
(3)利用反应H2(g)+CO(g)+O2(g)=H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池,已知该该电池使用KOH溶液作电解质溶液,则正极的电极反应式为_____________。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,则该电解总反应的离子方程式是________________。若电解100mL0.1mol/L的NaCl溶液,阴、阳两极各产生112mL气体(标准状况下),则所得溶液的pH为___________(忽略反应前后溶液的体积变化);若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生672mL气体(标准状况下)时,阴极析出的固体质量为____________g。
查看习题详情和答案>>
 CO+2H2的方法来制取高纯度的CO和H2。已知H2(g)、CO(g)和CH3OH(1)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol。请回答下列问题:
CO+2H2的方法来制取高纯度的CO和H2。已知H2(g)、CO(g)和CH3OH(1)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol。请回答下列问题:(1)反应CH3OH(1)=CO(g)+2H2(g)的△H=__________kJ/mol。
(2)标准状况下33.6LCO、H2的混合气体与足量氧气充芬反应后,将生成的CO2和水蒸气通入足量的Na2O2后,固体质量增加30.0g,则CO、H2的混合气体的平均相对分子质量为____________________________。
(3)利用反应H2(g)+CO(g)+O2(g)=H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池,已知该该电池使用KOH溶液作电解质溶液,则正极的电极反应式为_____________。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,则该电解总反应的离子方程式是________________。若电解100mL0.1mol/L的NaCl溶液,阴、阳两极各产生112mL气体(标准状况下),则所得溶液的pH为___________(忽略反应前后溶液的体积变化);若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生672mL气体(标准状况下)时,阴极析出的固体质量为____________g。