网址:http://m.1010jiajiao.com/timu3_id_71589[举报]
(7分)
熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3熔融混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
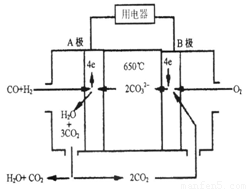
请回答下列问题:
(1)B极发生____(填“氧化”或“还原”)反应
(2)电池总反应为___________________________________________。
(3)以此电源电解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为 g。电解后溶液体积为1 L,溶液的pH约为 。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是
(用化学方程式表示)
查看习题详情和答案>>
(10分)熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。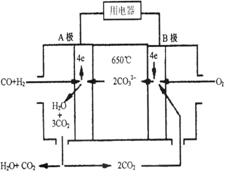
请回答下列问题:
(1)B极为_________极,发生_________(填“氧化”或“还原”)反应。
(2)电池总反应为___________________________________________。
(3)以此电源电解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为 g。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是 (用化学方程式表示)
Ⅰ.在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应: CO2(g) + 3H2(g)  CH3OH(g)
+ H2O(g) △H = -49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g)
+ H2O(g) △H = -49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:

(1)从反应开始到第10min,H2的转化率为 ,在 该条件下,反应的平衡常数K= ,如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡 (选填序号)。
a.向正向移动 b.向逆向移动
c.不移动 d.无法确定平衡移动方向
(2)下列措施中能使n(CH3OH)/n(CO2)增大的是 (选填序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
II.熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。请回答下列问题:

(1)A电极的电极反应方程式为 。
(2)常温下,用石墨作电极,以此电源电解一定量的CuSO4 溶液。当两极产生的气体体积相同时停止通电,若电解后溶液的体积为2L,溶液的pH=1(不考虑水解产生的H+),则阳极产生的气体的物质的量是 。
查看习题详情和答案>>
熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为
650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
请回答下列问题:
(1)B极为_________极,发生_________(填“氧化”或“还原”)反应
(2)电池总反应为___________________________________________。
(3)以此电源电解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为 g。电解后溶液体积为1 L,溶液的PH约为 。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是
(用化学方程式表示)
查看习题详情和答案>>熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
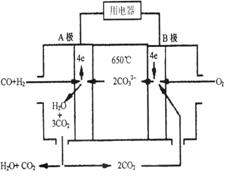
请回答下列问题:
(1)B极为_________极,发生_________(填“氧化”或“还原”)反应。
(2)电池总反应为___________________________________________。
(3)以此电源电解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为 g。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是 (用化学方程式表示)
查看习题详情和答案>>