摘要:以水为溶剂进行中和滴定的原理是:H3O++OH-====2H2O.已知液态SO2和纯水的导电性相近.因为液态SO2也能发生自电离:2SO2=SO32-+SO2+,△H>0.下列叙述中.错误的是( ) A.若以液态SO2为溶剂.用SOCl2滴定Na2SO3,该滴定反应可以表示为:SO32-+ SO2+=2SO2 B.在一定温度下.液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数 C.液态SO2中自电离的存在.说明SO2是离子化合物 D.适当升高温度.液态SO2的导电能力增强 [解析]选C.由信息得知SO2与H2O性质相似.为共价化合物.
网址:http://m.1010jiajiao.com/timu3_id_71098[举报]
(2007?深圳二模)以水为溶剂进行中和滴定的原理是:H3O++OH-═2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也能发生自电离:2SO2?SO
+SO2+;△H>0.下列叙述中,错误的是( )
2- 3 |
(2011?宝鸡一模)以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l)?SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是( )
查看习题详情和答案>>
以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l) SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
| A.该滴定反应可以表示为:SO32- + SO2+=2SO2 |
| B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数 |
| C.自离解的存在,说明SO2是离子化合物 |
| D.可通过导电能力变化来判断是否到达滴定终点 |
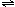 SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )