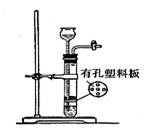
摘要:利用如右图所示装置制取Fe(OH)2,通电后溶液中产生的白色沉淀能保持较长时间不变色.下列说法错误的是( ) A.烧碱溶液注入容器前.需预先煮沸 B.甲电极上有氢气冒出 C.只能用铁作甲电极和乙电极 D.可用食盐水代替烧碱溶液
网址:http://m.1010jiajiao.com/timu3_id_70598[举报]
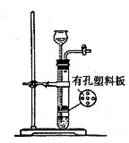
 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:①氯气与冷的氢氧化钠溶液反应生成NaClO;氯气与热的氢氧化钠溶液反应可生成NaClO和NaClO3.②在酸性较弱时KI只能被NaClO氧化,在酸性较强时亦能被NaClO3氧化.
(1)该小组利用如右图所示装置制取家用消毒液(主要成分为NaClO),a得到了氢气,则a为
阴极
阴极
(填“阳极”或“阴极”).生成NaClO的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.(2)该小组将0.784L(标准状况)Cl2通入50.00mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0mL.
①取稀释后的溶液25.00mL用醋酸酸化,加入过量KI溶液.用0.2000mol?L-1 Na2S2O3溶液滴定:I2+2S2O32-═2I-+S4O62-,消耗Na2S2O3溶液10.00mL时恰好到达终点.
②将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00mL.
①操作②中氯酸钠与碘化钾反应的离子方程式为
ClO3-+6I-+6H+═3I2+Cl-+3H2O
ClO3-+6I-+6H+═3I2+Cl-+3H2O
.②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为
1:1
1:1
.③计算氢氧化钠溶液的物质的量浓度.
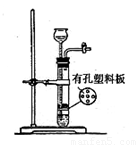
实验室可以使用如右图所示装置制取的气体,且药品选用也正确的是k*
 s*5u
s*5u
A.O2:二氧化锰和双氧水 B.SO2:亚硫酸钠和稀硫酸
C.CO2:大理石和稀硫酸 D.H2S:硫化亚铁和稀硫酸
查看习题详情和答案>>
实验室可以使用如右图所示装置制取的气体,且药品选用也正确的是k*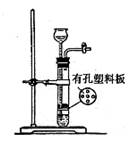 s*5u
s*5u
| A.O2:二氧化锰和双氧水 | B.SO2:亚硫酸钠和稀硫酸 |
| C.CO2:大理石和稀硫酸 | D.H2S:硫化亚铁和稀硫酸 |